
设NA为阿伏加德罗常数的值,下列叙述不正确的
A.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA
B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2 NA
C.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA
D.常温常压下,46 g NO2 与 N2O4的混合气体中含有的原子总数为3 NA
【知识点】阿伏加德罗常数
【答案解析】C 解析:A、溶液中包含乙醇中的氢原子和水中的氢原子,(5×46%÷46×6+5×54%÷18×2)×NA=0.6 NA故A正确;B、5.6 g铁过量,0.1 mol氯气完全反应,转移电子数为 0.2 NA,故B正确;C、二氧化锰与浓盐酸才能发生反应,随着反应的进行,浓盐酸会稀变成盐酸,反应停止,无法计算转移的电子数,故C错误;D、46 g NO2 与 N2O4的混合气体中含有的原子总数为46÷46×3NA=3NA,故D正确;
故答案选C
【思路点拨】本题考查阿伏加德罗常数,注意二氧化锰与浓盐酸才能发生反应,随着反应的进行,浓盐酸会稀变成盐酸,即使二氧化锰足量,盐酸也反应不完。


科目:高中化学 来源: 题型:
已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。使一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A 33.6 L。将反应后的溶液稀释到1 L,测得溶液中氢离子的浓度为0.1 mol·L-1。
(1)写出锌跟浓硫酸反应的化学方程式:_____________________________________
___________________________________________________________________。
(2)反应过程中消耗的H2SO4的物质的量是________________________。
(3)气体A的成分是______________,其体积比是______(标准状况下)(若为单一气体,此空不答)。
(4)反应过程中消耗的锌的质量是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种元素均位于第三周期,其原子序数逐渐增大,甲的最高价氧化物对应的水化物是强碱,乙是地壳中含量最多的金属元素,丙是本周期中原子半径最小的元素。下列说法不正确的是
A.甲是第IA元素,丙是第VIIA元素
B.甲、丙形成的化合物是离子化合物
C.乙的最高价氧化物是两性氧化物
D.丙是元素周期表中非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述正确的是(Fe 56)
A.1mol•L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数为NA,下列说法正确的是 ( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子
C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O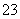 +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
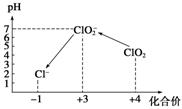
请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH | 少量Ba(OH)2溶液 | 2NH |
| B | Mg2+、HCO | 过量NaOH溶液 | Mg2++2HCO |
| C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
| D | Fe2+、NO | NaHSO4溶液 | HSO |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子
法”表示的化学方程式正确的是 ( )
A.5H218O2+2KMnO4+3H2SO4===518O2↑+K2SO4+2MnSO4+8H2O
B.CH3COOH+C2H518OH→CH3COOCH2CH3+H218O
C.2Na2O2+2H218O===4NaOH+18O2↑
D.K37ClO3+6HCl===K37Cl+3Cl2↑+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com