
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是( )
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
科目:高中化学 来源: 题型:
下列关于铝及其化合物的叙述正确的是( )
A.铝罐可久盛食醋(2014·福建理综,6C)
B.氢氧化铝可作胃酸的中和剂(2014·四川理综,1D)
C.明矾用作净水剂不涉及化学变化(2014·重庆理综,1A)
D.铝与Fe2O3发生铝热反应,反应后固体物质增重(2014·新课标全国卷Ⅱ,9C)
查看答案和解析>>
科目:高中化学 来源: 题型:
有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.NA表示阿伏加德罗常数,1 mol Na被完全氧化生成Na2O2,失去2NA个电子(2013·广东理综,9D)
B.Na2O2用作呼吸面具的供氧剂涉及氧化还原反应(2012·广东理综,10A)
C.苏打是面包发酵粉的主要成分之一(2014·福建理综,6D改编)
D.NaHCO3的热稳定性大于Na2CO3(2012·重庆理综,7B)
查看答案和解析>>
科目:高中化学 来源: 题型:
1.0 g镁在氧气中燃烧后增重0.64 g,但在空气中燃烧时增重不足0.64 g,其原因可能是( )
A.空气中镁燃烧肯定不完全
B.空气中部分镁与CO2反应
C.空气中镁部分与N2反应
D.空气中镁部分与水蒸气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3的制取方法及综合实验探究
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
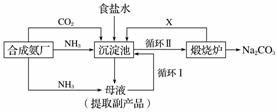
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是________________________________________________________________________。
②从生产流程图可知,可循环利用的物质是________。
③写出沉淀池中、煅烧炉中反应的化学方程式________________________________________________________________________。
(2)如何用CO2和50 mL 2 mol·L-1 NaOH溶液制取50 mL 1 mol·L-1 Na2CO3溶液?
①写出简要的实验步骤:_________________________________________。
②写出有关反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。表中对实验现象的描述或解释不正确的是( )
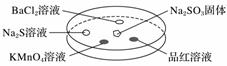
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是____________________________ 。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO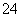 、Br-、HCO
、Br-、HCO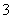 等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
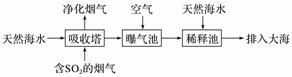
①向曝气池中通入空气的目的是_______________________________________________。
②通入空气后,曝气池中的海水与天然海水相比,浓度有明显不同的离子是________(填字母)。
a.Cl- b.SO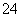 c.Br- d.HCO
c.Br- d.HCO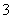
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
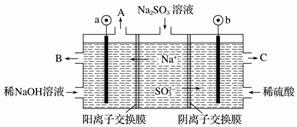
①图中a极连接电源的______(填“正”或“负”)极,C口流出的物质是________。
②SO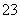 放电的电极反应为________________________。
放电的电极反应为________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释碱性增强的原因:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)固态物质一定是晶体( )
(2)冰和固体碘晶体中相互作用力相同( )
(3)晶体内部的微粒按一定规律周期性的排列( )
(4)凡有规则外形的固体一定是晶体( )
(5)固体SiO2一定是晶体( )
(6)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com