
| 80×mg |
| 46 |
| 40m |
| 23 |
| 2×mg |
| 46 |
| m |
| 23 |
| m |
| 23 |
| 22m |
| 23 |
| 22m |
| 23 |
| 22 |
| 122 |
| 40m |
| 23 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
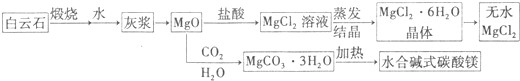
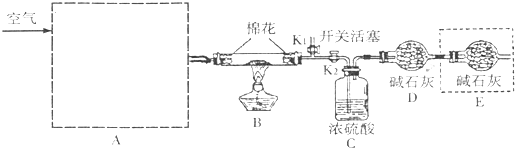
查看答案和解析>>
科目:高中化学 来源: 题型:
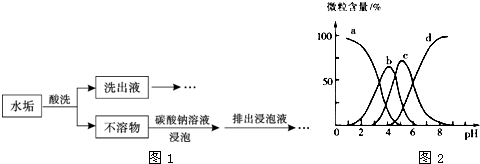
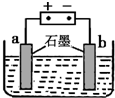
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、MgCl2 |
| C、NH4Cl |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 叙述 | 离子方程式 | 评价 |
| A | NaHCO3溶液中滴加少量的Ba(OH)2溶液 | Ba2++OH-+HCO3-=BaCO3↓+H2O | 正确 |
| B | 向NaOH溶液中滴加过量Ca(HCO3)2溶液 | OH-+HCO3-+Ca2+=CaCO3↓+H2O | 错误,Ca(HCO3)2溶液中阴阳离子比2:1 |
| C | 足量的Ba(HCO3)2溶液与NaHSO4溶液混合 | H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O | 正确 |
| D | 向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性 | Ba2++OH-+SO42-+H+=BaSO4↓+H2O | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
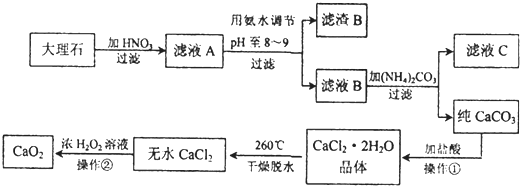
2- 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:
某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com