
 CO(g)£«H2(g)”÷H>0”£Ļņ¼×”¢ŅŅ”¢±ūČżøöŗćČŻČŻĘ÷ÖŠ¼ÓČėŅ»¶ØĮæCŗĶH2O£¬ø÷ČŻĘ÷ÖŠĪĀ¶Č”¢·“Ó¦ĪļµÄĘšŹ¼ĮæČēĻĀ±ķ£¬·“Ó¦¹ż³ĢÖŠCOµÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
CO(g)£«H2(g)”÷H>0”£Ļņ¼×”¢ŅŅ”¢±ūČżøöŗćČŻČŻĘ÷ÖŠ¼ÓČėŅ»¶ØĮæCŗĶH2O£¬ø÷ČŻĘ÷ÖŠĪĀ¶Č”¢·“Ó¦ĪļµÄĘšŹ¼ĮæČēĻĀ±ķ£¬·“Ó¦¹ż³ĢÖŠCOµÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£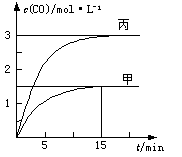
| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ČŻ»ż | 0.5 L | 0.5 L | V |
| ĪĀ¶Č | T1 ”ę | T2 ”ę | T1 ”ę |
| ĘšŹ¼Įæ | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
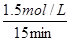 £½0.1 mol”¤L£1”¤min£1£¬ÕżČ·£»BĻīµ±±ūČŻĘ÷µÄĢå»żV£½0.5 L£¬øł¾ŻµČŠ§Ę½ŗāŌĄķCOµÄĘ½ŗāÅضČÓ¦Š”ÓŚ3.0mol/L£¬Ö»ÓŠĢå»żĖõŠ”²ÅÄÜŹ¹COµÄĘ½ŗāÅØ¶Č“ļµ½3.0mol/L£¬ÕżČ·£»CĻī¾Ż¼×ČŻĘ÷µÄĘ½ŗāÅØ¶Č¼ĘĖćĘ½ŗā³£ŹżK£½
£½0.1 mol”¤L£1”¤min£1£¬ÕżČ·£»BĻīµ±±ūČŻĘ÷µÄĢå»żV£½0.5 L£¬øł¾ŻµČŠ§Ę½ŗāŌĄķCOµÄĘ½ŗāÅضČÓ¦Š”ÓŚ3.0mol/L£¬Ö»ÓŠĢå»żĖõŠ”²ÅÄÜŹ¹COµÄĘ½ŗāÅØ¶Č“ļµ½3.0mol/L£¬ÕżČ·£»CĻī¾Ż¼×ČŻĘ÷µÄĘ½ŗāÅØ¶Č¼ĘĖćĘ½ŗā³£ŹżK£½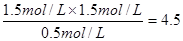 £¬“ķĪó£»DĻīÓÉÓŚ¹ĢĢåĪļÖŹ²»Ó°ĻģĘ½ŗā£¬Ōņ¼×”¢ŅŅĮ½ČŻĘ÷ČōŌŚĶ¬ĪĀÄÜ“ļµ½Č«µČĘ½ŗā£¬¼“n(H2O)=0.5mol£¾0.4mol£¬ŌŁ½įŗĻÕż·“Ó¦ĪüČČ£¬ĖµĆ÷ŅŅČŻĘ÷µÄĪĀ¶ČµĶ£ØT1£¾T2£©£¬“ķĪó”£
£¬“ķĪó£»DĻīÓÉÓŚ¹ĢĢåĪļÖŹ²»Ó°ĻģĘ½ŗā£¬Ōņ¼×”¢ŅŅĮ½ČŻĘ÷ČōŌŚĶ¬ĪĀÄÜ“ļµ½Č«µČĘ½ŗā£¬¼“n(H2O)=0.5mol£¾0.4mol£¬ŌŁ½įŗĻÕż·“Ó¦ĪüČČ£¬ĖµĆ÷ŅŅČŻĘ÷µÄĪĀ¶ČµĶ£ØT1£¾T2£©£¬“ķĪó”£

 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĆŗČ¼ÉÕŹ±æɽ«Č«²æ»ÆѧÄÜ×Ŗ»ÆĪŖČČÄÜ |
| B£®µē½āČŪČŚAl2O3Ź±½«²æ·Ö»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ |
| C£®ĒāŃõČ¼ĮĻµē³ŲÄÜĮæ×Ŗ»ÆŠ§ĀŹøߣ¬æɽ«Č«²æ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ |
| D£®Ć¾ĢõČ¼ÉÕŹ±½«²æ·Ö»ÆѧÄÜ×Ŗ»ÆĪŖ¹āÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 ŹµŃé²āµĆ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗāŹż¾ŻĮŠÓŚĻĀ±ķ£ŗ
ŹµŃé²āµĆ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗāŹż¾ŻĮŠÓŚĻĀ±ķ£ŗ
| A£®2v(NH3)=v(C02)”””””””””””””””” | B£®ĆܱÕČŻĘ÷ÖŠ×ÜŃ¹Ēæ²»±ä |
| C£®ĆܱÕČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä | D£®ĆܱÕČŻĘ÷ÖŠ°±ĘųµÄĢå»ż·ÖŹż²»±ä |
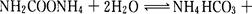
 øĆŃŠ¾æŠ”×é·Ö±šÓĆČż·Ż²»Ķ¬³õŹ¼ÅØ¶ČµÄ°±»ł¼×Ėįļ§ČÜŅŗ²ā¶ØĖ®½ā·“Ó¦ĖŁĀŹ£¬µĆµ½C(NH2C00-)Ėꏱ¼äµÄ±ä»ÆĒ÷ŹĘČēĶ¼ĖłŹ¾”£
øĆŃŠ¾æŠ”×é·Ö±šÓĆČż·Ż²»Ķ¬³õŹ¼ÅØ¶ČµÄ°±»ł¼×Ėįļ§ČÜŅŗ²ā¶ØĖ®½ā·“Ó¦ĖŁĀŹ£¬µĆµ½C(NH2C00-)Ėꏱ¼äµÄ±ä»ÆĒ÷ŹĘČēĶ¼ĖłŹ¾”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦ĖŁĀŹ±ķŹ¾µÄŹĒ»Æѧ·“Ó¦½ųŠŠµÄĻŽ¶Č |
| B£®»Æѧ·“Ó¦ĖŁĀŹæÉŅŌÓƵ„Ī»Ź±¼äÄŚ·“Ó¦ĪļÅØ¶ČµÄ¼õÉŁĮæĄ“±ķŹ¾ |
| C£®¶ŌÓŚČĪŗĪ»Æѧ·“Ó¦Ą“Ėµ£¬·“Ó¦ĖŁĀŹŌ½æģ£¬·“Ó¦ĻÖĻó¾ĶŌ½Ć÷ĻŌ |
| D£®»Æѧ·“Ó¦ĖŁĀŹæÉŅŌŹĒÕżÖµ£¬Ņ²æÉŅŌŹĒøŗÖµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

| ĪļÖŹ | HCOOH | CH3OH | HCOOCH3 |
| Ö÷ŅŖ ŠŌÖŹ | ĪŽÉ«ŅŗĢ壬ÓėĖ®»„ČÜ K(HCOOH)>K(CH3COOH) | ĪŽÉ«ŅŗĢ壬ÓėĖ®»„ČÜ | ĪŽÉ«ŅŗĢ壬ŌŚĖ®ÖŠČܽā¶ČŠ”£¬Óė“¼»„ČÜ |
 HCOOH(l) + CH3OH(l)£¬·“Ó¦ĪüČČ£¬µ«ģŹ±äµÄÖµŗÜŠ””£³£ĪĀ³£Ń¹ĻĀ£¬Ė®½ā·“Ó¦ĖŁĀŹŗĶĘ½ŗā³£Źż¶¼½ĻŠ””£
HCOOH(l) + CH3OH(l)£¬·“Ó¦ĪüČČ£¬µ«ģŹ±äµÄÖµŗÜŠ””£³£ĪĀ³£Ń¹ĻĀ£¬Ė®½ā·“Ó¦ĖŁĀŹŗĶĘ½ŗā³£Źż¶¼½ĻŠ””£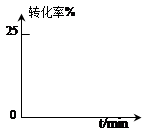
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 N2(g)+3H2(g)£¬ŌŚ673K”¢30MPaĻĀ£¬n(NH3)ŗĶn(N2)Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
N2(g)+3H2(g)£¬ŌŚ673K”¢30MPaĻĀ£¬n(NH3)ŗĶn(N2)Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ 
| A£®t1Ź±·“Ó¦“ļµ½Ę½ŗā |
| B£®t3Ź±£¬vÕż(N2)©vÄę(N2) |
| C£®t2Ź±ŗĶt3Ź±n(H2)ĻąµČ |
| D£®t3ŗó£¬ČōĢå»ż²»±ä³äHe£¬·“Ó¦ĖŁĀŹŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 M(g)£«N(g)£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
M(g)£«N(g)£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ| ŹµŃé ±ąŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Ź±ĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | |
| n(X) | n(Y) | n(M) | ||
| ¢Ł | 700 | 0.40 | 0.10 | 0.090 |
| ¢Ś | 800 | 0.10 | 0.40 | 0.080 |
| ¢Ū | 800 | 0.20 | 0.30 | a |
| ¢Ü | 900 | 0.10 | 0.15 | b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

A£®Ķ¼¢Ł±ķŹ¾ĻņŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėXŗĶY·¢Éś·“Ó¦£ŗ2X(g)+Y(g)  3Z(g) ”÷H©0£¬WµćXµÄÕż·“Ó¦ĖŁĀŹµČÓŚMµćXµÄÕż·“Ó¦ĖŁĀŹ 3Z(g) ”÷H©0£¬WµćXµÄÕż·“Ó¦ĖŁĀŹµČÓŚMµćXµÄÕż·“Ó¦ĖŁĀŹ |
B£®Ķ¼¢Ś±ķŹ¾Ń¹Ēæ¶ŌæÉÄę·“Ó¦A(g)+2B(g) 3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ±Č¼×µÄŃ¹Ē抔 3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ±Č¼×µÄŃ¹Ē抔 |
| C£®¾ŻĶ¼¢Ū£¬ČōŅŖ³żČ„CuSO4ČÜŅŗÖŠµÄFe3+£¬æɼÓČėNaOHČÜŅŗÖĮPHŌŚ4×óÓŅ |
| D£®³£ĪĀĻĀ£¬Ļ”ŹĶ0.1mol/LNa2CO3ČÜŅŗ£¬Ķ¼¢ÜÖŠµÄׯ×ų±źæɱķŹ¾ČÜŅŗÖŠHCO3-µÄŹżÄæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com