
科目:高中化学 来源: 题型:解答题
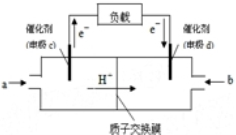 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 mol Na2CO3的溶液中有Na+的个数为NA | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 3.01×1023个SO2分子的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
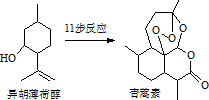 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
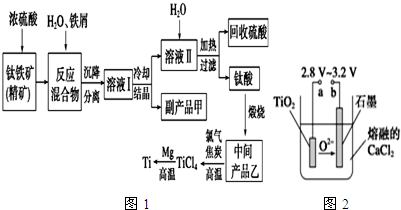
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com