
| A. | 适当升高温度,CH3COOH的电离程度减小 | |
| B. | 加少量NaOH固体,CH3COOH的电离平衡向正方向移动 | |
| C. | 加少量0.2 mol/L 的HCl溶液,溶液中c(H+)增大,平衡向正方向移动 | |
| D. | 加少量CH3COONa固体,CH3COOH的电离平衡向正方向移动 |
分析 醋酸的电离是吸热反应,升高温度促进醋酸电离,向醋酸溶液中加入能和氢离子反应的物质能促进醋酸电离,加入含有氢离子或醋酸根离子的物质能抑制醋酸电离.
解答 解:A.醋酸的电离是吸热反应,升高温度促进醋酸电离,所以醋酸的电离程度增大,故A错误;
B.向醋酸中加入氢氧化钠固体,氢氧根离子和氢离子反应导致氢离子浓度降低,所以促进醋酸电离,故B正确;
C.向醋酸中加入少量盐酸,增大了溶液中氢离子浓度,从而抑制醋酸电离,故C错误;
D.向醋酸中加入少量醋酸钠固体,增大了溶液中醋酸根离子浓度,从而抑制醋酸电离,故D错误;
故选B.
点评 本题考查了弱电解质的电离,加热或加入与氢离子反应的物质能促进醋酸电离,同离子效应能抑制醋酸电离.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 使元素的化合态转化成游离态的过程可能是还原的过程 | |
| B. | 高炉炼铁的原料有铁矿石、焦炭和空气.工业上就是用焦炭还原铁矿石以制得生铁 | |
| C. | 电解熔融氧化铝时,每还原出2.7kg铝,必有300mol电子转移 | |
| D. | 工业上常用电解熔融NaCl的方法制取金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 用剩的药品应收集起来放回原试剂瓶中 | |
| C. | 振荡试管中液体时,手拿住试管,用手腕甩动 | |
| D. | 称量物质时先取小砝码,再依次取较大的砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
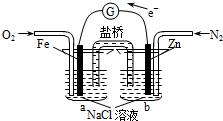
| A. | 该装置将电能转化为化学能 | B. | Fe电极发生了氧化反应 | ||
| C. | 烧杯a中的溶液pH降低 | D. | 烧杯b中发生的反应为Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅用于光导纤维 | |
| C. | SiO2不溶于水,也不溶于任何酸 | |
| D. | 用带玻璃瓶塞的试剂瓶盛放NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com