
| A、H+ |
| B、I- |
| C、Na+ |
| D、SO42- |
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
131 53 |
137 55 |
131 53 |
| A、53 | B、78 |
| C、131 | D、184 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难溶电解质的溶度积越小,溶解度越大 |
| B、一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
| C、升高温度,物质的溶解度都会增大 |
| D、可以通过沉淀反应使杂质离子完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度前者大于后者 |
| B、中和两者需要的NaOH的物质的量相同 |
| C、混合后pH不变 |
| D、稀释相同倍数,醋酸的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L H2O中含有的分子数为NA |
| B、32g O2中含有的分子数为NA |
| C、在1L水中溶解58.5g NaCl,即可配制得1mol?L-1的NaCl溶液 |
| D、1L 1mol?L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA |
| B、13g NO2和33g N2O4混合气体中含N原子数为NA |
| C、28g CO和22.4L N2含有的分子数均为NA |
| D、等物质的量的NH4+和OH-含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若两种粒子的核外电子排布完全相同,则化学性质一定相同 |
| B、如果两原子的核外电子排布相同,则一定属于同一种元素 |
| C、含有最高价元素的化合物一定具有强氧化性 |
| D、阳离子只能得电子被还原,做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
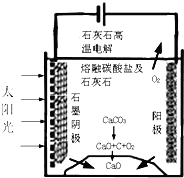 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com