
【题目】某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法不正确的是
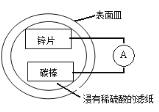
A.锌片作负极
B.碳棒上有气泡产生
C.电子由锌片经导线流向碳棒
D.可将电能转化为化学能
【答案】D
【解析】
Zn、碳和稀硫酸构成原电池中,锌为负极,发生失去电子的氧化反应,电极反应式为Zn﹣2e﹣═Zn2+,碳为正极,发生得到电子的还原反应,电极反应式为2H++2e﹣=H2↑,电池工作时,电子从负极锌沿导线流向正极碳,内电路中阳离子移向正极,阴离子移向负极,据此解答。
A.Zn、碳和稀硫酸构成原电池中,Zn能与稀硫酸反应,而碳不能,Zn发生失去电子的氧化反应,锌为负极,故A正确;
B.碳为正极,发生得到电子的还原反应,电极反应式为2H++2e﹣=H2↑,所以碳棒上有气泡产生,故B正确;
C.电池工作时,电子从负极锌沿导线流向正极碳,故C正确;
D.原电池是将化学能转化为电能的装置,故D错误;
故答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究得到了迅速发展。像电一样,氢是一种需要依靠其他能源,如石油、煤、原子能等的能量来制取的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为“一级能源”,如煤、石油、太阳能和原子能等。发展民用氢能源,首先必须制得廉价的氢气。
⑴氢气燃烧时耗氧量小,发热量大。已知热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
C(g)+O2(g)=CO2(g) △H=-393.5 kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生的热量的比值是________(保留两位小数)。
⑵某些科学家对以下3个反化学反应很感兴趣:
①3FeCl2+4H2O=Fe3O4+6HCl+H2
②2Fe3O4+3Cl2+12HCl=6FeCl3+6H2O+O2
③6FeCl3=6FeCl2+3Cl2
科学家研究上述反应意义在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g) C(s) +2H2(g) ΔH=+75 kJ·mol1;消碳反应:CO2(g) +C(s) 2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如下图。

下列说法正确的是
A.高压利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
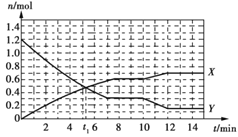
A. t1 min时,正、逆反应速率相等
B. 曲线X表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。
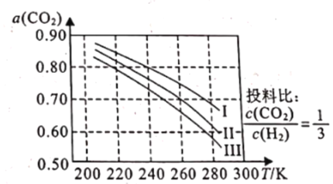
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________。[已知:Ksp[Ni(OH)2]=5×10-16]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
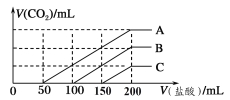
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A.1molNH4+所含电子数为10NA
B..5.6LCO2中含有的分子数为0.25NA
C.1.2gMg与足量稀硫酸反应,转移的电子数为0.1NA
D.常温常压下,32gO2和O3的混合气体所含原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com