
【题目】下列属于非电解质的是
A. Cu B. SO2 C. MgO D. 乙酸
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
A→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂的名称是: ,作用是: 。
(4)装置C中酒精灯的作用是: 。
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
滴定次数 | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 1.04 | 25.03 |
2 | 1.98 | 25.99 |
3 | 3.20 | 25.24 |
①写出滴定过程中所发生的2个离子方程式:
、
。
②样品中氯化亚铁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站。某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是

A.Li+、K+移向左侧电极
B.外电路中电子由右侧电极移向左侧电极
C.通入1 mol气体A时,左侧电极上生成5 mol CO2
D.相同条件下通入气体B与气体C的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | CaCO3 | HF | SO2 |
B | NaCl | NH3 | BaSO4 |
C | Fe | HCl | 蔗糖 |
D | HNO3 | Fe(OH)3 | Cl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2NaClO3 + H2SO4 + SO2===2ClO2 + 2NaHSO4,下列叙述正确的是
A. NaClO3是还原剂 B. SO2被氧化 C. SO2发生还原反应 D. ClO2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
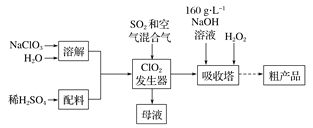
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25mL2mol/L的Na2CO3溶液和75mL1mol/L的稀盐酸: ①将Na2CO3溶液缓缓滴加到盐酸中 ②将稀盐酸缓缓滴加到Na2CO3溶液中。在标准状况下产生的气体情况是
A. 均为0.84L B. 均为0.56L C. ①<② D. ①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com