
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是
A.S2Cl2既作氧化剂又作还原剂
B.H2O作还原剂
C.每生成1molSO2转移4mol电子
D.氧化产物与还原产物物质的量之比为3∶1
科目:高中化学 来源:2017届云南曲靖市高三上学期第三次月考化学试卷(解析版) 题型:选择题
“天宫二号”于2016年9月15日发射成功,是我国科技发展的集中体现。关于能源和材料,下列说法错误的是
A.光导纤维在信息产业中有广泛的应用,制造光导纤维的主要材料是二氧化硅
B.煤的干馏、气化和液化均属于化学变化
C.即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源
D.复合材料属于有机分子材料
查看答案和解析>>
科目:高中化学 来源:2017届山东师范大学附属中学高三上第二次模拟考试化学试卷(解析版) 题型:填空题
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇(CH3OH)、二甲醚(CH3OCH3)等。已知:
甲醇合成反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1
二甲醚合成反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.5kJ·mol-1
则由H2和CO2制备二甲醚2CO2(g)+6H2(g)=CH3OCH3(g) +3H2O(g)的△H____kJ·Mol-1
+3H2O(g)的△H____kJ·Mol-1
(2)甲醇是一种可再生的清洁能源,具有开发和应用的广阔前景。
已知:25℃,1.01×105Pa时,1.6g液态甲醇完全燃烧,当恢复到原状态时,放出36.29kJ的热量,写出表示甲醇燃烧热的热化学方程式________________________________。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下,将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O+2H+;2HNO2+O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1.0g铵态氮元素转化为硝态氮元素时需氧气的质量为_______g。
②写出加入甲醇后反应的离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东师范大学附属中学高三上第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.单质硅可用于制造光纤和太阳能电池
B.火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质
C.在常温下可用铝制容器贮藏运输浓硫酸
D.BaSO4难溶于酸,所以可以用稀盐酸和Ba(NO3)2溶液检验SO42-
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
向KI溶液中逐滴加入少量CuSO4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析中不正确的是
A.充分反应后的溶液中无Cu2+存在
B.滴加CuSO4溶液时,每生成1molCuI会转移1mole-
C.根据上述实验现象可知:Cu2+比I2的氧化性强
D.通入SO2时发生反应的离子方程式为SO2+I2+2H2O===2HI+2H++SO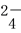
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B. 做蒸馏实验时在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即补加
C. 振荡分液漏斗时应关闭其玻璃塞和活塞
D. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高一上10月月考化学试卷(解析版) 题型:选择题
下列离子检验的方法正确的是:
A.某溶液 有白色沉淀,说明原溶液中有Cl﹣
有白色沉淀,说明原溶液中有Cl﹣
B.某溶液 有白色沉淀,说明原溶液中有SO42﹣
有白色沉淀,说明原溶液中有SO42﹣
C.某溶液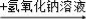 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液 生成无色气体,说明原溶液中有CO32﹣
生成无色气体,说明原溶液中有CO32﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高二上10月月考化学试卷(解析版) 题型:选择题
分子式为C5H7Cl的有机物,其结构不可能是
A.只有一个双键的直链有机物 B.含有两个双键的直链有机物
C.含有一个双键的环状有机物 D.含有一个三键的直链有机物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考一化学试卷(解析版) 题型:填空题
在2 L密闭容器内,80℃时反应:2NO(g)+O2(g)
L密闭容器内,80℃时反应:2NO(g)+O2(g)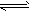 2NO2(g),反应体系中,n(NO)随时间t的变化如下表
2NO2(g),反应体系中,n(NO)随时间t的变化如下表
时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
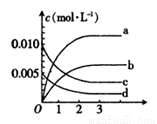
(1)如图表示NO2变化曲线的是________。(填字母)。用O2表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ _。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2 气体
气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
e.等温等容时,充入氦气
f.等温等压时充入氦气
(4)若将2molNO和1molO2充入两个密闭容器中,保持一定温度进行反应:
2NO(g)+O2(g)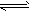 2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
(5)如果按物质的量之比为2:1充入NO和O2的混合气体,则达到平衡时NO与O2的转化率 之比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com