
 (3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算
(3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.RO2 | B.RO3 | C.R2O3 | D.R2O5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.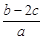 | B.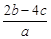 | C.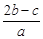 | D.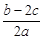 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该原子的摩尔质量是aNA g |
B.W g该原子的物质的量一定是 mol mol |
C.W g该原子中含有 ×NA个该原子 ×NA个该原子 |
D.由已知信息可得:NA= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n(KOH) = 0.1mol | B.n(KOH) < n(KHCO3) |
| C.n(KHCO3) = 0.2mol | D.n(KOH) > n(KHCO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 |
| B.定容时,俯视刻度线 |
| C.定容时,仰视刻度线 |
| D.移液时,有少量液体溅出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com