
【题目】![]() ,加水稀释
,加水稀释![]() 的氨水,下列判断正确的是
的氨水,下列判断正确的是
A.原氨水的浓度![]()
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中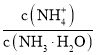 的增大
的增大
D.再加入![]() 的盐酸,混合液
的盐酸,混合液![]()
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
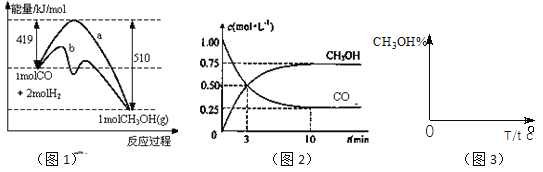
请回答下列问题:
(1)在“图1”中,曲线___(填:a或b)表示使用了催化剂;该反应属于_____(填:吸热、放热)反应。
(2)下列说法正确的是_____
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线________(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)![]() xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)

A.P3>P4,y轴表示C的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:

(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式______。
(2)用电子式表示⑥和⑨形成化合物的过程:______。
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为 ______(用化学式表示)。
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 ______。
(5)⑤、⑥、⑩的离子半径由大到小的顺序为 ______(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是引起“温室效应”的主要物质,节能减排,高效利用化石能源,控制
是引起“温室效应”的主要物质,节能减排,高效利用化石能源,控制![]() 排放,探索
排放,探索![]() 的循环利用是保护环境,促进经济科持续发展的重要举措.
的循环利用是保护环境,促进经济科持续发展的重要举措.
(1)在一定温度下,向2L固定容积的密闭容器中通入2mol![]() ,3mol
,3mol![]() ,发生反应为:
,发生反应为:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图1所示.
的浓度随时间变化如图1所示.
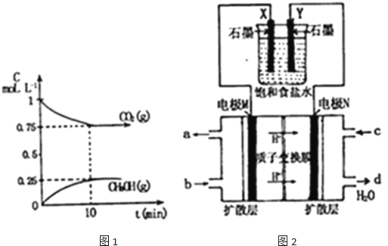
①能说明该反应已达到平衡状态的是 ______
A.![]() 体积分数在混合气体中保持不变
体积分数在混合气体中保持不变
B.单位时间内有![]()
![]() 断裂,同时有
断裂,同时有![]()
![]() 键生成
键生成
C.混合气体的密度不随时间变化
D.当体系中![]() :
:![]() :l,且保持不变
:l,且保持不变
②下列措施能使![]() 增大的是 ______
增大的是 ______
A.升高温度 ![]() 恒温恒容充入
恒温恒容充入![]()
![]() 使
使![]() 变成
变成![]()
D.恒温恒容下,再充入2mol![]() ,3mol
,3mol![]()
③计算该温度下此反应的平衡常数![]() ______ ;若使
______ ;若使![]() 应采取的措施是 ______
应采取的措施是 ______
A.增大压强![]() 恒压加入一定量
恒压加入一定量![]() C.恒容通入
C.恒容通入![]() D.降低温度
D.降低温度![]() 升高温度
升高温度
(2)如图2所示:用某甲醇燃料电池作电源电解饱和食盐水.
①写出电极N发生的反应式: ______
②若食盐水体积为300Ml,电解过程溶液体积变化忽略不计,常温下测得![]() 时,理论上消耗甲醇质量为 ______
时,理论上消耗甲醇质量为 ______ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL![]() 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下![]()
![]() 时,所得溶液中各离子浓度由大到小的顺序为______
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的![]() 醋酸溶液中加水稀释后,下列说法正确的是______.
醋酸溶液中加水稀释后,下列说法正确的是______.
A.溶液中导电粒子的数目减少 ![]() 醋酸的电离程度增大,
醋酸的电离程度增大,![]() 亦增大
亦增大
C.溶液中 不变
不变 ![]() 溶液中
溶液中 减小
减小
(3)①常温下将![]() 稀硫酸
稀硫酸![]() 与
与![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则![]() :
:![]() ______
______![]() 溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由![]() 的HA溶液
的HA溶液![]() 与
与![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,则下列说法正确的是______
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则![]()
B.若![]() ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则![]() 一定大于
一定大于![]()
D.若反应后溶液呈碱性,则![]() 一定小于
一定小于![]()
(4)常温下,浓度均为![]() 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
溶质 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根据表中数据,将浓度均为![]() 的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN![]()
![]()
![]()
②根据以上数据,判断下列反应可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)几种离子开始沉淀时的pH如下表:
离子 |
|
|
|
pH |
|
|
|
当向含相同浓度![]() 、
、![]() 、
、![]() 离子的溶液中滴加NaOH溶液时,______
离子的溶液中滴加NaOH溶液时,______![]() 填离子符号
填离子符号![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )

A. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 装置①可用于分离C2H5OH和H2O的混合物
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com