
(8分)在某温度下,将![]() 和
和![]() 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定![]() 的变化,5S时测定
的变化,5S时测定![]() =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,![]() 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是![]() = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
(1) ![]() (2)
(2)![]()
(3) 0.25 (4) 80%
解析:解:(1) ![]() 和
和![]() 的反应方程式为:
的反应方程式为:![]()
由速率公式:![]()
![]() 得
得
![]()
![]()
=![]()
![]()
∵化学反应速率之比与方程式中的系数比是一个正比关系![]()
∴![]()
![]() =
=![]()
![]()
(2)平衡常数就是在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度的方次乘积与反应物浓度的方次乘积的比值,用K表示。所以![]() 的K的表达式为
的K的表达式为![]() 。
。
(3)解:设![]() 浓度的变化为xmol/L.
浓度的变化为xmol/L. ![]()
![]()
![]()
始(mol/L) 0.01 0.01
变 x x 2x
平 0.01-x 0.0080 2x
依题可列等式: 0.01-x=0.0080
X=0.002(mol/L)
K=![]() =
=![]() =0.25
=0.25
(4) ![]() 是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2
是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2![]() ymol.
ymol.
![]()
始(mol) 0 0 0.2
变 y y 2y
平 0.080 0.080 0.![]() 2-2y
2-2y
依题可列等式: y=0.0080(mol/L)
∴![]()
![]() =80%
=80%


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:山东省高青一中2009-2010学年度高二上学期期末模块检测考试化学试题 题型:013
|
某温度下按下图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是:
| |
| [ ] | |
A. |
用锌粒来 表示10 s内该反应的速率为0.013 g/s |
B. |
忽略锥形瓶内溶液体积的变化,用H+来 表示10 s内该反应的速率0.01 mol/(L·s) |
C. |
忽略锥形瓶内溶液体积的变化,用Zn2+来 表示10 s内该反应的速率0.01 mol/(L·s) |
D. |
用H2来 表示10 s内该反应的速率为0.004 mol/(L·s) |
查看答案和解析>>
科目:高中化学 来源:湖南师大附中高二化学选修4结业考试理科试题 题型:填空题
(8分)在某温度下,将 和
和 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定 的变化,5S时测定
的变化,5S时测定 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中, 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是 = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
查看答案和解析>>
科目:高中化学 来源:湖南师大附中高二化学选修4结业考试理科试题 题型:填空题
(8分)在某温度下,将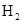 和
和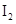 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定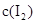 的变化,5S时测定
的变化,5S时测定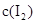 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,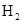 的平均消耗速率为
mol/L·S;
的平均消耗速率为
mol/L·S;
(2)反应的平衡常数的表达式是 =
;
=
;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(共8分)(1)在某温度下,H2O的离子积常数为1×10-13,则在该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH=
(2)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com