
| A. | 4和5 | B. | 5和4 | C. | 4和6 | D. | 6 和4 |
分析 芳香化合物C8H8O2,属于酯时,分子中含有酯基,可能含有1个侧链-OOCCH3或-COOCH3或-CH2OOCH,若含有2个侧链,则为-CH3、-OOCH,存在邻、间、对三种位置关系;
若为羧酸,则含有苯环和-COOH,可能含有1个侧链-CH2COOH,可能有2个侧链:-CH3和-COOH,有邻、间、对三种位置关系.
解答 解:芳香化合物C8H8O2,①属于酯时,分子中含有酯基,可能含有1个侧链-OOCCH3或-COOCH3或-CH2OOCH,总有3种结构;若含有2个侧链,则为-CH3、-OOCH,存在邻、间、对三种位置关系,所以属于酯的有机物总共有6种;
②属于羧酸时含有苯环和-COOH,可能含有1个侧链-CH2COOH,可能有2个侧链,为-CH3、-COOH,有邻、间、对三种位置关系,符合条件的有机物为: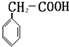 或
或 或
或 或
或 ,共有4种,
,共有4种,
故选D.
点评 本题考查了同分异构体的书写与判断,题目难度中等,明确同分异构体的概念及书写原则为解答关键,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g)只有达到限度时才有2v(O2)=v(SO3) | |
| C. | 对于反应2SO2(g)+O2(g)?2SO3(g)达到限度时,增大容器容积能减小正反应速率 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)?2SO3(g) | |
| B. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深H2(g)+I2(g)?2HI(g) | |
| D. | 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象等 |
| Ⅰ | 先向2mL 0.1mol/L FeC12溶液中滴加KSCN溶液,再滴加新制氯水 | ①滴加KSCN溶液后,溶液无明显变化;滴加新制氯水后,溶液变变成红色 ②FeC12溶液与新制氯水反应的离子方程式2Fe2++Cl2═2Fe3++2Cl- |
| Ⅱ | 先向2mL 0.1mol/L FeC13溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 | 滴加KSCN溶液后,溶液变红色;滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象等 |
| Ⅲ | 先向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加KSCN溶液 | 滴加FeC13溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变为红色.根据实验现象可以推测出Fe3+有可能与I-发生了氧化还原反应. |
| 编号 | 操作 | 现象及结论 |
| Ⅳ | 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加①再滴加淀粉溶液(或CCl4;或铁氰化钾溶液) | 现象:溶液变蓝. 结论:Fe3+能与I-发生氧化还原反应生成②I2,③Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )
2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )| A. | 该过程可以表示为:CO+O$\frac{\underline{\;催化剂\;}}{\;}$C02 | |
| B. | 该过程中有热量放出 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 钌催化剂能改变该反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com