
| A、Al在氧气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| B、铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸 |
| C、明矾可用于除去酸性废水中的悬浮颗粒 |
| D、用高纯度的二氧化硅制作的光导纤维遇强碱会“断路” |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
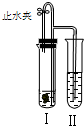 如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )| A | B | C | D | |
| Ⅰ | CaCO3、稀HCl | Na2CO3、稀H2SO4 | Zn、稀H2SO4 | Cu、稀H2SO4 |
| Ⅱ | KNO3 | NaCl | BaCl2 | Ba(OH)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
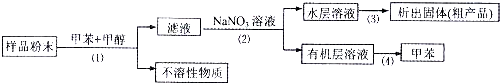
| A、步骤(1)需要用到过滤装置 |
| B、步骤(2)需要用到分液装置 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)需要用到布氏漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
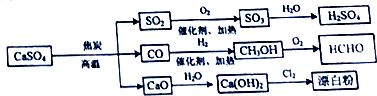
| A、漂白粉的主要成分为Ca(ClO)2 |
| B、蔗糖中加入浓硫酸,搅拌后产生大量的CO2、SO2、SO3 |
| C、SO2、CH3OH、HCHO 都能使酸性高锰酸溶液褪色 |
| D、CaO 是碱性氧化物,CO、SO2、SO3都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x等于6 |
| B、性质稳定,不易脱色 |
| C、易溶于强酸和强碱 |
| D、可用氧化物形式表示BaO?CuO?2SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | HF | HCN | H2C2O4 | |
| 电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=5.9×10-2 | Ka2=6.4×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com