
����Ŀ����һþ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�ꡣ
(1)���ںϽ������˵����ȷ����________��
A���Ͻ�ֻ�������ֻ��������ϵĽ������
B���Ͻ��Ӳ��һ�������ɳɷֽ�����Ӳ�ȴ�
C��þ���۳ɺϽ�Ĺ�����һ����ѧ����
D���Ͻ���۵�һ�������ɳɷֵ��۵��
E���Ͻ�߱�����������
(2) �úϽ���þ���������ֱ�Ϊ________g��________g��
(3) ��Ӧ�й��ռ�������µ����������Ϊ___________L��
(4)��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ����Ҫʹ����ǡ�ôﵽ���ֵ����Ҫ����NaOH________L��
���𰸡�BDE 24g 27g 56 1
��������
(1) �Ͻ��������ֻ��������ϵĽ���(�������ǽ���)�ں���һ���γɵľ��н������Ե����ʣ��Ͻ��Ӳ��һ��ȳɷֽ������۵�һ��ȳɷֽ����͡�
(2) þ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�꣬��Ӧ��������ҺΪMgCl2��AlCl3�Ļ��Һ����Ͻ���þ�����ʵ���Ϊamol���������ʵ���Ϊbmol����24a+27b=51�����ⷴӦ��MgCl2��AlCl3�Ļ��ҺΪ�����ԣ���2a+3b=5��
(3)���ݵ����غ㼴�ɽ�÷�Ӧ���������������ʵ�����
(4) ��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ��������ǡ�ôﵽ���ֵʱ��������ҺΪNaCl���ɵ���غ��֪n(Cl-)=n(Na+)��
(1) A���Ͻ��������ֻ��������ϵĽ���(�������ǽ���)�ں���һ���γɵľ��н������Ե����ʣ���A����
B���Ͻ��Ӳ��һ��ȳɷֽ�����B��ȷ��
C��þ���۳ɺϽ�Ĺ�����һ���������̣���C����
D���Ͻ���۵�һ��ȳɷֽ����ͣ�����D��ȷ��
E���Ͻ��Ǿ��н������Ե����ʣ���E��ȷ��
�ʴ�ΪBDE��
(2) þ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�꣬��Ӧ��������ҺΪMgCl2��AlCl3�Ļ��Һ����Ͻ���þ�����ʵ���Ϊamol���������ʵ���Ϊbmol����24a+27b=51�����ⷴӦ��MgCl2��AlCl3�Ļ��ҺΪ�����ԣ���2a+3b=5���ⷽ����24a+27b=51��2a+3b=5�ã�a=b=1����þ���Ͻ���Mg������Ϊ1mol��24g/mol=24g��Al������Ϊ1mol��27g/mol=27g��
(3) �跴Ӧ���������������ʵ���Ϊnmol�����ݵ����غ�ɵ�1mol��2+1mol��3=nmol��2����ã�n=2.5�������������ڱ���µ����Ϊ2.5mol��22.4L/mol=56L��
(4) ��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ��������ǡ�ôﵽ���ֵʱ��������ҺΪNaCl���ɵ���غ��֪n(Cl-)=n(Na+)=1L��5 mol��L��1=5mol��������NaOH��Һ��NaOH�����ʵ���Ϊ5mol����Һ���Ϊ![]() =1L��
=1L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д���������ʵĻ�ѧʽ:
����_____________________ ����_____________________
�մ�_____________________ ����__________________
��2����SO2����ͨ��Ʒ����Һ�У�����Ϊ_____��������Һ���Ⱥ�����Ϊ________����Cl2ͨ����ɫʯ����Һ�У�����Ϊ_____����SO2ͨ����ɫʯ����Һ�У�����Ϊ______��
��3����ҵ�Ͻ�����ͨ�������ʯ��[Ca(OH)2]�м��Ƶ�Ư�ۣ�д���÷�Ӧ�Ļ�ѧ����ʽ_____���ڸ÷�Ӧ�У�����������_____���û�ѧʽ��ʾ����
��4��̼�����ƿ���������θ�ᣨ��Ҫ�����ᣩ�����ҩ����д���÷�Ӧ�����ӷ���ʽ________
��5����������ΪDZˮͧ�ͺ��������������Դ����_____________��������ɫΪ______��
��6�����Թ������һ��ͭƬ��ע��һ�������Ũ���� �����Թܼ��ȣ�ʹ֮��Ӧ����ͭƬ����ʣ�࣬����_______������ϣ�������������û����������������_____________;������������Һ�м�������________���ʣ�ͭƬ������ܽ⡣
A.KNO3 �� B.FeCl3������C.���ᡡ��������D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Co)���������ȺϽ�Ӳ�ʺϽ𡢷����Ͻ𡢴��ԺϽ�������ε���Ҫԭ�ϣ������������ Fe ǿ�� Cu��ij��λ����ͭ��ijɷ�Ϊ��CoS��CuFeS2��CaS��SiO2�� һ������������������������ܺ�ͭ�Ĺ���������ͼ��

�ش��������⣺
(1)Cu2+���������ԭ�����£�

�¶ȳ��� 50������ʼ����½�����ԭ����_____�������������ӵĽ���ԭ������ͼ���ƣ� д���� CoS ���� Co2+�����ӷ���ʽ_____��
(2)����������Ҫ�ɷ�Ϊ_____��
(3)��ȡ����ͭ��ԭ�����£�Cu2++2(HR)org![]() (CuR2)org+2H+���������̣�����ȡ������Լ�Ӧ��Ϊ_____(д��ѧʽ)��
(CuR2)org+2H+���������̣�����ȡ������Լ�Ӧ��Ϊ_____(д��ѧʽ)��
(4)���������м��� H2O2��������Һ�� pH �� 4���� Fe2+ת��Ϊ FeOOH ���˳�ȥ��д����ת�������ӷ���ʽΪ_____������ Fe2+�Ƿ���ȫ��ת�����Լ�Ϊ_____��
(5)ͨ����ⷨ�ƵõĴ��ܺ�������ͭ��������Ҫ��⾫�������о���ʱ������Ӧ����_____��(����������������)�����������Ҫ�ɷ�Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����ǿ�������Һ�ֱ������������������еĸ�һ���Ҳ��ظ���NH![]() ��Ba2+��H+��Na+��SO42-��CO32-��NO3-��OH����֪������A��D�е���C�����г������ɣ�
��Ba2+��H+��Na+��SO42-��CO32-��NO3-��OH����֪������A��D�е���C�����г������ɣ�
����A��B�зֱ�μ�D���ɼ��ȣ�������������(����֪��D��B��Ӧ���ɵ������ܱ�A����)����������������ˮ���ܷ�Ӧ����D�� �Իش��������⣺
��1��д��A��B��C��D������Һ�����ʵĻ�ѧʽ��
A______________��B______________��C______________��D______________��
��2����A��D��Ӧ���ɵ����建��ͨ�뺬KOH��Ca(OH)2��NaAlO2�Ļ����Һ�У����ɳ��������ʵ���n��ͨ����������V�Ĺ�ϵ�ɱ�ʾ______________������ĸ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�������ݻ���ͬ�������٢ڢ��н������·�Ӧ��3A(g)��B(g) ![]() 2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��
2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��

A. �ۢڢ�B. �ۢ٢�C. �٢ڢ�D. �ڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ������ͼ��ʾ��
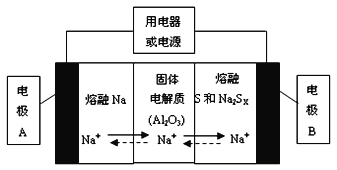
�ٸ������ұ����ݣ������жϸõ�ع���������Ӧ������_________������ĸ����Χ�ڡ�
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050 |
�е�/�� | 892 | 444.6 | 2980 |
a��100������ b��100��300�� c��300��350�� d��350��2050��
�ڷŵ�ʱ���缫AΪ_________�����缫B����_________��Ӧ������������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX=2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ��________________��

��2��������������Ϊ��Դ��������װ��KI��������Һ��ͼ��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ��___________���Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ�___________��
��3��������������Ϊ��Դ������ͼ��ʾװ�ý���ʵ�����ҳغͱ��أ�

��������������0.05xmol��Sʱ���������ҳ���B������������__________g����ʱ��װ����___________������C������D�����缫����7.20g���������װ���е�ij����Һ������_______������ţ���
a.MgSO4��Һ b.CuSO4��Һ c.NaCl��Һ d.AgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ú��ʯ��Ԥ��������Ҫ��SiO2��61%����Al2O3��30%����������Fe2O3��FeO����þ�Ļ�����ȡ�ijʵ��С����������ȡAl(OH)3

��1��������������з�������Ҫ��Ӧ�����ӷ���ʽΪ_______________��
��2������������Ŀ����_____________������Fe3+�ķ�����______________��
��3������I����Ҫ�ɷ�________��������ķ�Ӧ����ʽ______________��
��4������ת����ʱ��Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ƿ�и�ʢ��100mL 5mol��L-1�����������������Һ��������ƿ�зֱ��������������ۣ���Ӧ����������ɵ���������ס��ң�2��3����ͬ״��������������۵�����Ϊ�� ��
A.2.7gB.3.6gC.5.4gD.6.75g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܼ��仯����㷺Ӧ���ڴ��Բ��ϡ���ز��ϼ���Ӳ���ϵ�����
��1��CoxNi(1-x)Fe2O4������Co��Ni��Ϊ+2��������H2O2�ֽ�Ĵ��������нϸߵĻ��ԡ�
�ٸô�������Ԫ�صĻ��ϼ�Ϊ______��
��ͼ1��ʾ���ֲ�ͬ�����ƵõĴ���CoxNi(1-x)Fe2O4��10��ʱ���ֽ�6%��H2O2��Һ����Գ�ʼ������x�仯���ߡ���ͼ����Ϣ��֪��______________����ȡ�õ��Ĵ������Ը��ߣ�Co2+��Ni2+���������д�Ч�����õ���______��
��2�����������Ʊ��ܵ����������Ҫԭ�ϡ���ͼ2Ϊ��ˮ�ϲ����ܣ�CoC2O4��2H2O���ڿ��������ȵ������仯���ߣ�������300�漰�������ù����Ϊ�������
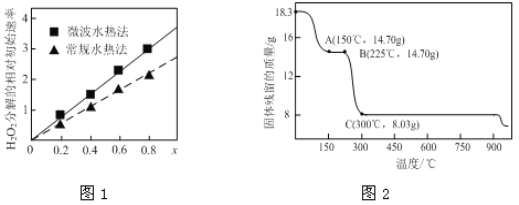
��ͨ������ȷ��A��ʣ�����Ļ�ѧ�ɷ�Ϊ________________���ѧʽ������д��B���Ӧ��������O2��225��~300�淢����Ӧ�Ļ�ѧ����ʽ��_________________________________________��
��ȡһ�������Ķ�ˮ�ϲ����ֽܷ��������������Co�Ļ��ϼ�Ϊ+2��+3������480 mL 5 mol/L����ǡ����ȫ�ܽ���壬�õ�CoCl2��Һ��4.48 L����״��������ɫ���塣��ȷ��������������Co��O�����ʵ���֮��Ϊ___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com