
分析 (1)①Ni是28号元素,其原子核外有28个电子,根据构造原理书写其基态原子核外电子排布式;
该化合物中C元素化合价为+2价、O元素化合价为-2价,根据化合物中各元素化合价代数和为0确定Ni元素化合价;
②分子晶体熔沸点较低,不同非金属元素之间易形成极性键,含有孤电子对和含有空轨道的原子之间易形成配位键;
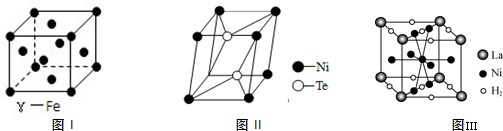
(2)①该结构为面心立方结构,图I γ-Fe结构中每个铁原子周围距离最近且相等的铁原子数目=3×8÷2;
②利用均摊法计算该晶胞中Ni、Te原子个数,从而确定其化学式;
③利用均摊法计算该晶胞中氢气分子与La个数比从而计算含1mol La的合金可吸附H2的数目.
解答 解:(1)①Ni是28号元素,其原子核外有28个电子,根据构造原理书写其基态原子核外电子排布式1s22s22p63s23p63d84s2;
该化合物中C元素化合价为+2价、O元素化合价为-2价,根据化合物中各元素化合价代数和为0确定Ni元素化合价为0,
故答案为:1s22s22p63s23p63d84s2;0;
②分子晶体熔沸点较低,所以Ni(CO)4是分子晶体,C-O原子之间存在极性键,Ni-C原子之间存在配位键,所以该物质中含有极性键和配位键,
故答案为:极性键、配位键;
(2)①该结构为面心立方结构,图I γ-Fe结构中每个铁原子周围距离最近且相等的铁原子数目=3×8÷2=12,故答案为:12;
②利用均摊法计算该晶胞中Ni、Te原子个数,该晶胞中Te原子个数是2,Ni原子个数=8×$\frac{1}{8}$=1,所以其化学式为NiTe2,故答案为:NiTe2;
③该晶胞中La原子个数=8×$\frac{1}{8}$=1、氢气分子个数=2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,所以La和氢气分子个数之比为1:3,则含1mol La的合金可吸附H2的数目为3mol,故答案为:3mol.
点评 本题考查晶胞计算、化学键判断等知识点,侧重考查学生分析计算及空间想象能力,难点是配位数的计算方法,题目难度不大.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 | |
| D. | 取皂化反应后的混合液滴入热水中,观察现象,可判断皂化反应是否完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油是一种清洁能源,燃烧不会产生任何污染 | |
| B. | 在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 | |
| C. | 乙醇的燃烧热为683.4kJ/mol | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. |  处理尾气 | |
| D. | 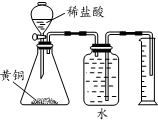 测定黄铜(Cu、Zn合金)中Zn 的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com