
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
【答案】AlP+3H2O=Al(OH)3+PH3 PH或电导率 共价 二 3:10 2Ca(ClO)2+PH3=H3PO4+2CaCl2 ClO-+H2OHClO+OH- Ca(OH)2或CaO > 水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性
【解析】
⑴根据题意写出反应方程式。
⑵根据已知信息,检验空气中微量的磷化氢主要是看溶液的pH值或电导率,HgCl2溶于水,所得溶液几乎不导电,说明不存在离子,因此在溶液中不电离则为共价化合物。
⑶根据甲足量氢氧化钠溶液得到NaH2PO2得出亚磷酸为二元酸;根据化合价升降守恒和生成的产物中质量守恒分析得出白磷和氢氧化钠的物质的量之比。
⑷根据氧化还原反应原理书写化学方程式,次氯酸要水解生成的次氯酸更快的与磷化氢反应。
⑸磷酸被氢氧化钙或氧化钙反应生成磷酸钙,CaHPO4溶液中水解程度大于电离程度,因此溶液显碱性。
⑴磷化铝(AlP)片剂,遇水蒸气放出PH3气体,化学方程式为AlP+3H2O=Al(OH)3+PH3,故答案为:AlP+3H2O=Al(OH)3+PH3。
⑵HgCl2溶于水,所得溶液几乎不导电,发生反应PH3+3HgCl2=P(HgCl)3↓+3HCl,氯化氢易溶于水,所以可以通过测定溶液pH或电导率变化,准确测定空气中微量的PH3。HgCl2溶于水,所得溶液几乎不导电,说明不能电离出离子,因此HgCl2属于共价化合物,故答案为:pH或电导率;共价。
⑶①根据在足量的NaOH溶液作用下生成的亚磷酸钠的化学式得出亚磷酸属于二元酸,故答案为:二。
②当反应I生成的n(NaH2PO2):n(Na2HPO3) = 3:1时,假设n(NaH2PO2) = 3 mol,n(Na2HPO3) = 1 mol,则化合价升高+1×3 + (+3)×1 = 6,白磷中磷的化合价降低变为PH3,一个磷降低3个价态,需要2mol磷降低,因此总消耗磷的物质的量为3+1 + 2 = 6mol,即白磷1.5 mol,消耗氢氧化钠物质的量为3mol×1 + 1mol×2 = 5mol,因此参加反应的n(P4):n(NaOH) = 1.5:5 =3:10,故答案为3:10。
⑷用漂白粉可将PH3氧化为H3PO4,化学方程式为2Ca(ClO)2+PH3=H3PO4+2CaCl2,含有水蒸气时可加快PH3的氧化过程,次氯酸钙水解生成次氯酸,次氯酸具有更强的氧化性,可以更快地氧化磷化氢,因此离子方程式表示原因为ClO- + H2O HClO + OH-,故答案为:2Ca(ClO)2+PH3= H3PO4+ 2CaCl2;ClO- + H2O HClO + OH-。
⑸①试剂X主要是将磷酸等物质转变为磷酸钙,因此X试剂主要是Ca(OH)2或CaO,故答案为:Ca(OH)2或CaO。
②CaHPO4悬浊液中有HPO32-,HPO32-既能电离,也能水解,电离常数为H3PO4的第三步电离常数,即Ka3=4.4×10-13,水解常数Kh=![]() =
=![]() =1.59×10-7>Ka3,所以主要是水解为主,因此CaHPO4悬浊液pH >7,故答案为:>;水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性。
=1.59×10-7>Ka3,所以主要是水解为主,因此CaHPO4悬浊液pH >7,故答案为:>;水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)![]() Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() 是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH;③已知乳酸E的结构简式为
2CH3COOH;③已知乳酸E的结构简式为![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
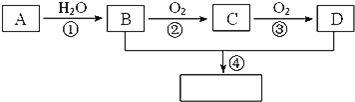
回答下列问题:
(1)A的电子式 ______,A结构简式______。
(2)B的结构简式 ______,D的结构简式 ______。
(3)B和D的分子中分别含 ______和______两种官能团(写名称)。
(4)写出下列反应的化学方程式并注明反应类型:
A→B ______; ______。
B→C______; ______。
B和D反应生成乙酸乙酯的反应并注明反应类型:______; ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
A. 反应物的总能量高于生成物的总能量
B. 若生成2mol液态水,则放出的热量大于148.9 kJ
C. 当v正(HF)=2v逆(H2O)时,反应达到平衡状态
D. 平衡后放出的热量随加入SiO2量的增加而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关文献记载中涉及的化学知识表述不正确的是( )
A.“以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B.“墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C.“丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D.《本草纲目》中记载:“烧酒非古法也,……,用浓酒和糟入甑,蒸令气上,用器承取滴露。”涉及的操作方法是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列说法正确的是( )
2SO3(g) ΔH<0。下列说法正确的是( )
A.达到平衡后,升高温度平衡正向移动B.达到平衡时:v(O2)=2v(SO2)
C.达到平衡后,降低温度O2的浓度将减小D.升高温度,正反应速率增加,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数为X最外层电子数的一半,X、Y、Z的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2的结构式为Y≡X—Z—Z—X≡Y。下列说法正确的是
A.(XY)2中X元素的化合价为+3
B.Y的氧化物对应的水化物是强酸
C.化合物W(Y3)2中只含有离子键
D.X和Z组成的化合物中不可能所有原子都达到8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com