已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子.M和W均有“生物金属”之称,M
4+离子和氩原子的核外电子排布相同;W处于周期表中第8列.请回答下列问题:
(1)1mol B
2A
2分子中含σ键的数目是
.
(2)BC
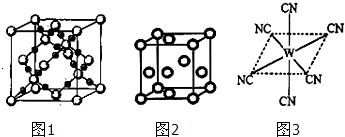
2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图1所示.则该晶体的类型属于
晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为
.
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图2.则晶胞中M原子的配位数为
;若该晶胞的密度为ρ g/cm
3,阿伏加德罗常数为N
A,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为
cm.
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O
2在体内的正常运输.已知W
2+与KCN溶液反应得W(CN)
2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示.
①W元素基态原子价电子排布式为
.
②已知CN-与
(一种分子)互为等电子体,则1个CN-中π键数目为
.
(5)光谱证实单质D与强碱溶液反应有[D(OH)
4]
-生成,则[D(OH)
4]
-中存在
.
a.共价键 b.配位键 c.σ键 d.π键.




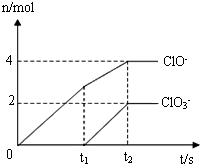 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O. (1)25°C时,NaOH和Na2CO3两溶液的pH均为11.
(1)25°C时,NaOH和Na2CO3两溶液的pH均为11. 短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23.X的原子半径比Y的小,X与W同主族,Z的最外层电子数是电子层数的3倍,M是地壳中含量最高的金属元素.