
| 碘含量(以I计) | 符合(20~50)mg/kg的标准 |
| 配 料 | 天然海盐 碘酸钾 |
| 保 质 期 | 密封包装24个月 |
| 5 |
| 6 |
| ||
| 5.0g |
| 103 |
| 10-3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下:
用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下:| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 1.00mL | 25.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
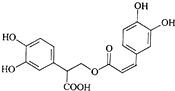
| A、迷迭香酸的所含官能团为:羟基、羧基、酯基和苯环 |
| B、1mol迷迭香酸最多能和8mol H2发生加成反应 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和含5mol Br2单质完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
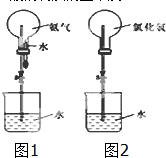 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).| 1 |
| 5 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、容量瓶洗净后没有干燥 |
| D、定容时仰视容量瓶瓶颈刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
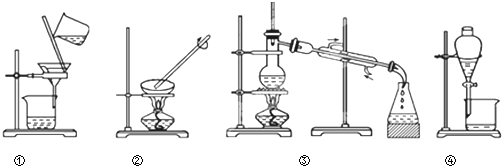
| A、蒸发、蒸馏、过滤、萃取 |
| B、过滤、蒸馏、蒸发、萃取 |
| C、过滤、蒸发、蒸馏、分液 |
| D、蒸馏、蒸发、过滤、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑨⑩ |
| B、①④⑦⑧⑨⑩ |
| C、①③④⑦⑧⑨ |
| D、①②④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 烷 基 | 氟化物 | 氯化物 | 溴化物 | 碘化物 |
| 沸点℃ | 沸点℃ | 沸点℃ | 沸点℃ | |
| CH3- | -78.4 | -24.2 | 3.6 | 42.4 |
| CH3-CH2- | -37.7 | 12.3 | 38.40 | 72.3 |
| CH3-CH2-CH2- | 2.5 | 46.60 | 71.0 | 102.4 |
| (CH3)2-CH- | -9.4 | 35.7 | 59.48 | 89.14 |
| CH3-CH2-CH2-CH2- | 32.5 | 78.44 | 101.6 | 130.5 |
| (CH3)2-CH CH2- | 16.0 | 68.7 | 91.7 | 120.4 |
| (CH3)3C- | 12.1 | 52 | 73.25 | 120.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com