
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |
分析 A、C的主要化合价都是+2,应该处于ⅡA族,根据原子半径A>C可知,C为Be、A为Mg元素;
B为+3价,其原子半径大于C、小于A,则B为Al元素;
D、E都有-2价,但E没有正化合价,则E为O元素、D为S元素;
F、G的主要化合价为+1,应该处于ⅠA族,原子半径F<Mg,则F为Li元素,则G只能为H元素;
H为+7价,则位于ⅤⅡA族,H的原子半径大于O元素,则H为Cl元素,据此进行解答.
解答 解:A、C的主要化合价都是+2,应该处于ⅡA族,根据原子半径A>C可知,C为Be、A为Mg元素;B为+3价,其原子半径大于C、小于A,则B为Al元素;D、E都有-2价,但E没有正化合价,则E为O元素、D为S元素;F、G的主要化合价为+1,应该处于ⅠA族,原子半径F<Mg,则F为Li元素,则G只能为H元素;H为+7价,则位于ⅤⅡA族,H的原子半径大于O元素,则H为Cl元素,
(1)A、B、C、F分别为Mg、Al、Be、Li元素,原子序数分别为12、13、4、3,四种元素在周期表中的位置如下图: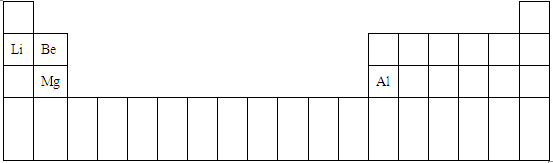 ,
,
故答案为:
(2)C、H两元素分别为Be、Cl,二者最高价氧化物所对应的水化物分别为Be(OH)2、HClO4,联系氢氧化镁难溶于水可知Be(OH)2也难溶于水,二者反应的离子方程式为:Be(OH)2+2H+═Be2++2H2O,
故答案为:Be(OH)2+2H+═Be2++2H2O;
(3)F为Li、E为O元素,锂在氧气中燃烧生成氧化锂,反应的化学反应方程式为:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O,
故答案为:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O;
(4)D为S、H为Cl元素,根据反应Cl2+S2-﹦2Cl-+S可知,氯气的氧化性大于S,说明Cl元素的非金属性大于S,
故答案为:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据标准数据合理推断各元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.


科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.
研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 | |
| C. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| D. | 根据反应速率的大小可知化学反应进行的相对快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
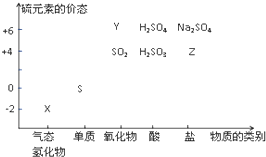 物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图所示
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图所示 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2=2S↓+2H2O;
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2=2S↓+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| D. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O<H2S<H2Se | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:Li>Na>K>Rb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com