
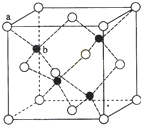
 请完成下列各题:
请完成下列各题:分析 (1)Ga是31号元素,其基态原子核外有31个电子,根据构造原理书写其原子核外电子排布式;
(2)单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
(3)根据GaN的构成微粒确定晶体类型;
(4)根据晶胞结构判断存在的化学键;
(5)根据$ρ=\frac{m}{V}$计算;a位置As原子与b位置Ga原子之间的距离为晶体体对角线的$\frac{1}{4}$.
解答 解:(1)Ga原子是31号元素,根据构造原理写出Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,
故答案为:1s22s22p63s23p63d104s24p1;
(2)GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体,
故答案为:4;正四面体;
(3)GaN晶体结构与单晶硅相似,GaN属于原子晶体,故答案为:原子;
(4)碳原子可以形成4个碳碳单键,所以每个As应与4个Ga相连,金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为σ键,又因为砷原子还有1对孤对电子,而镓原子有容纳孤对电子的空轨道,所以还可以构成配位键,
故答案为:BEG;
(5)晶胞中Ga位于体内,数目为4,As原子位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×(70+75)g/mol}{6.02×10{\;}^{23}mol{\;}^{-1}}$,晶胞体积为(564×10-10cm)33,则密度为$\frac{4×(70+75)}{6.02×10{\;}^{23}×(564×10{\;}^{-10}){\;}^{3}}$=5.37g/cm3;
a位置As原子与b位置Ga原子之间的距离为晶体体对角线的$\frac{1}{4}$,则距离为$\frac{1}{4}$×$\sqrt{3}$×564×10-10cm=141$\sqrt{3}$,
故答案为:5.37;141$\sqrt{3}$.
点评 本题考查了物质结构和性质,明确物质结构是解本题关键,结构决定性质,知道电负性大小的判断方法、电子式的书写规则,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑. ,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.
,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个120° | B. | 5个108° | C. | 4个109°28′ | D. | 6个109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯与30g乙烷中含有的极性共价键个数之比2:3 | |
| B. | 常温、常压下,22.4L C2H4气体完全加成需要lmolBr2 | |
| C. | C2H6和C4H10不一定是同系物 | |
| D. | 1molH2O2完全分解时转移电子2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
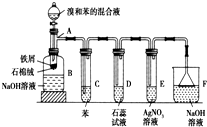 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
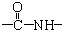 、一个
、一个 、一个
、一个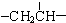 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为: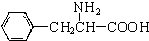 ,另一种水解产物结构简式为:CH3CH(NH2)COOH;
,另一种水解产物结构简式为:CH3CH(NH2)COOH;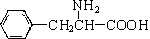 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(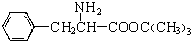 )和CH3OH,则醇X的结构简式为(CH3)3COH.
)和CH3OH,则醇X的结构简式为(CH3)3COH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入石灰水中 | B. | 将CO2通入饱和纯碱溶液中 | ||
| C. | 将CO2通入水玻璃中 | D. | 将H2S通入CuSO4溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com