
| A. | f能级 | B. | d能级 | C. | s能级 | D. | p级 |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
相同状况下,n mol氢气和n mol二氧化碳的体积相同,下列解释比较全面的是:①n mol氢气和n mol二氧化碳所含的气体分子数目相同;②相同状况下,氢分子间的平均距离和二氧化碳分子间的平均距离大致相等;③氢分子本身的大小和二氧化碳分子本身的大小大致相同;④气体分子本身大小相对分子间平均距离来说可忽略不计
A.①②③ B.①②④ C.①④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
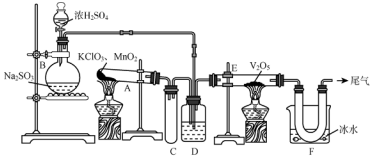
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
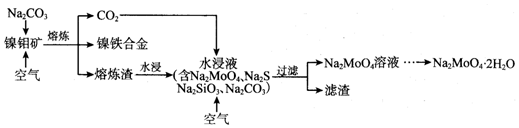

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
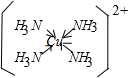 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol•L-1 | |
| B. | 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中c(NH4)+:①<② | |
| C. | pH=3的0.1mol•L-1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
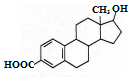
| A. | 该有机物的分子式为C19H22O3 | |
| B. | 该分子中所有碳原子不可能在同一个平面内 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测得0.10mol/LCH3COOH溶液中存在较多的CH3COOH分子 | |
| B. | 比较等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成H2的体积 | |
| C. | 比较等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量 | |
| D. | 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com