
【题目】完成下列各问题:
(1)①泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:__________;
②TiCl4水解生成TiO2·xH2O的化学方程式__________;
③酸性高锰酸钾溶液与草酸溶液反应的化学方程式____________;
④硫代硫酸钠溶液与稀硫酸反应的化学万式____________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出
①电荷数守恒_________;
②物料守恒___________;
③质子守恒___________;
④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)_________。
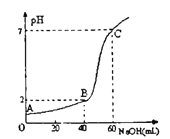
(3)常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。所用NaOH溶液浓度为____________。
【答案】 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ TiCl4+(2x+2)H2O![]() TiO2·xH2O+4HCl 5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) c(H+)+c(H2CO3)= c(OH-)+c(CO32-) c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>C(CO32-) 0.03mo1/L
TiO2·xH2O+4HCl 5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) c(H+)+c(H2CO3)= c(OH-)+c(CO32-) c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>C(CO32-) 0.03mo1/L
【解析】(1)①泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,其反应的离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ ;②TiCl4水解生成TiO2·xH2O,设TiCl4的系数为1,根据元素守恒,TiO2·xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),化学方程式TiCl4+(2x+2)H2O![]() TiO2·xH2O+4HCl ;③酸性溶液KMnO4与草酸发生氧化还原反应,KMnO4→MnSO4,Mn元素的化合价从+7价降低到+2价得到5个电子,被还原,得到还原产物MnSO4,H2C2O4→2CO2中C元素升高失去2个电子,被氧化得到氧化产物CO2,根据得失电子守恒,KMnO4与H2C2O4,的计量数之比为2:5,再根据原子守恒平衡酸性高锰酸钾溶液与草酸溶液反应的化学方程式5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O ;④硫代硫酸钠遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,硫代硫酸钠溶液与稀硫酸反应的化学万式Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O;(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出①电荷数守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-);②物料守恒c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) ;③将②代入①,消去c(Na+),得质子守恒c(H+)+c(H2CO3)= c(OH-)+c(CO32-);④NaHCO3溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,则c(CO32-)<c(H2CO3),c(Na+)不水解,浓度最大,下列粒子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>C(CO32-);(3)设HCl的浓度是x mol·L-1,NaOH溶液浓度为y mol·L-1,结合图象则有:①20×10-3L×x mol·L-1=60×10-3L×y mol·L-1,②20×10-3L×x mol·L-1-40×10-3L×y mol·L-1=0.01 mol·L-1×(20+40)×10-3L,根据①②解得:x=0.09mol·L-1,y=0.03mol·L-1,即HCl的浓度是0.09mol·L-1,NaOH溶液浓度为0.03mol·L-1。
TiO2·xH2O+4HCl ;③酸性溶液KMnO4与草酸发生氧化还原反应,KMnO4→MnSO4,Mn元素的化合价从+7价降低到+2价得到5个电子,被还原,得到还原产物MnSO4,H2C2O4→2CO2中C元素升高失去2个电子,被氧化得到氧化产物CO2,根据得失电子守恒,KMnO4与H2C2O4,的计量数之比为2:5,再根据原子守恒平衡酸性高锰酸钾溶液与草酸溶液反应的化学方程式5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O ;④硫代硫酸钠遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,硫代硫酸钠溶液与稀硫酸反应的化学万式Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O;(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出①电荷数守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-);②物料守恒c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) ;③将②代入①,消去c(Na+),得质子守恒c(H+)+c(H2CO3)= c(OH-)+c(CO32-);④NaHCO3溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,则c(CO32-)<c(H2CO3),c(Na+)不水解,浓度最大,下列粒子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>C(CO32-);(3)设HCl的浓度是x mol·L-1,NaOH溶液浓度为y mol·L-1,结合图象则有:①20×10-3L×x mol·L-1=60×10-3L×y mol·L-1,②20×10-3L×x mol·L-1-40×10-3L×y mol·L-1=0.01 mol·L-1×(20+40)×10-3L,根据①②解得:x=0.09mol·L-1,y=0.03mol·L-1,即HCl的浓度是0.09mol·L-1,NaOH溶液浓度为0.03mol·L-1。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】正丁烷与异丁烷互为同分异构体的依据是
A. 具有相似的化学性质
B. 具有相同的物理性质
C. 分子具有相同的空间结构
D. 分子式相同,但分子内碳原子的连结方式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝合金8.3g溶于300mL2mol/L盐酸时,在标准状况下产生气体5.6L。若向反应后的溶液中加入适量烧碱溶液,充分搅拌,生成沉淀的最大质量为
A. 9g B. 16.8g C. 18.5g D. 22.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验. 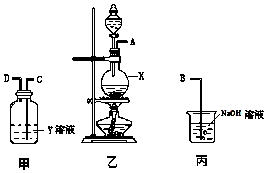
请回答下列问题:
(1)仪器X的名称为 .
(2)Y溶液可以是 , 相应的实验现象是 .
(3)丙装置的作用是 . 写出丙装置中反应方程式
(4)写出铜与浓硫酸反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌
D.超导材料K3C60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-过氧化氢燃料电池具有比能量高。安全方便等优点。其结构示意图如图所示、关于该电池的叙述正确的是
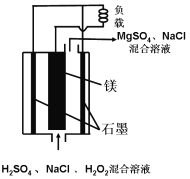
A. 该电池能在高温下正常工作
B. 电池工作时,H+向正极移动
C. 电池工作时,正极周围溶液的PH将不断变小
D. 该电池的总反应式为: 该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若电路中通过2 mol电子,则电池内部释放632 kJ热能
D. 若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com