
(1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为________________________________________。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为______________
______________________________________________________________。
(3)肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为______________________________________________________________________________________________________________________________。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)==CO2(g)+H2(g) △H<0欲提高CO转化率,可采用的方法是( )
①降低温度; ②增大压强; ③使用催化剂;④增大CO浓度; ⑤增大水蒸气浓度
A.①②③ B.④⑤ C.①⑤ D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组拟设计如下图所示实验装置验证Ba(OH)2溶液和H2SO4溶液发生的是离子反应(夹持仪器略去)。
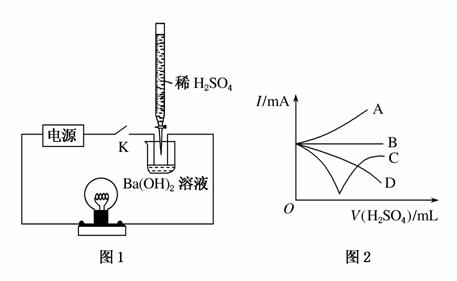
(1)该小组按图1连好装置后,接通开关K,旋转滴定管活塞使稀H2SO4缓缓滴下直至过量。图1装置中观察到的现象是______________________;能说明该反应是离子反应的依据是________。
(2)写出该反应的离子方程式____________________________。
(3)下列三种情况下,与(2)中离子方程式相同的是________。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO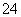 恰好完全沉淀
恰好完全沉淀
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(4)上述(1)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的________曲线表示。(填曲线对应字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应的能量变化如图所示。下列有关叙述正确的是( )
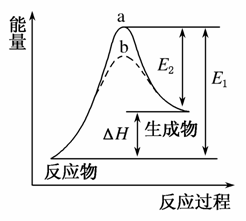
A.该反应的反应热ΔH=E2-E1
B.a、b分别对应有催化剂和无催化剂的能量变化
 C.催化剂能降低反应的活化能
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:

某小组为研究电化学原理,设计如图装置。下列叙述错误的是( )
A.a和b不连接时,铁片质量会增加
B.a和b用导线连接时,正极发生的电极反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均被腐蚀
D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:4OH--4e-===2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某兴趣小组用如图装置做了两次实验。
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通氧气,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。

(1)实验①,甲池通氢气的Pt电极为________极,电极反应式为__________________________。
(2)实验②,乙池通氧气的Pt电极为________极,电极反应式为__________________________。
(3)两次实验中原电池的总反应相同,总反应的离子方程式为________________________________。
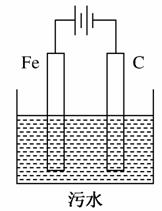
Ⅱ.电解 池污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
池污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
(1)电解处理过程中,若污水中离子浓度较小,导电能力较差,处理效率下降,此时可向污水中加入适量的________(填选项字母)。
A.BaSO4 B.CH3COOH
C.NaNO3 D.CH3OH
(2)电解处理过程中,阳极实际发生了两个电极反应,阳极的电极反应式分别是①______________________________;②__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O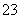 +O2+aOH-===Y+S4O
+O2+aOH-===Y+S4O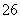 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O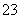 是还原剂
是还原剂
D.每有1 mol O2参加反应,转移的电子为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
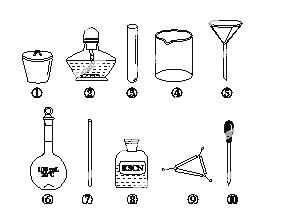
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com