
【题目】当光束通过下列分散系时,可能产生丁达尔效应的是( )
A.NaHCO3溶液B.蔗糖溶液
C.CuSO4溶液D.淀粉溶液
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

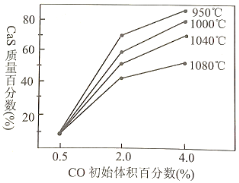
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。
回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)AsCl3分子中砷的杂化类型是___________;AsO43-的空间构型是___________。
(3)电子亲和能是反映元素性质的参数之一,电子亲和能指基态气态原子得1个电子形成负一价阴离子时释放的能量(kJ·mol-1),第四周期主族元素Ga、Ge、As、Se、Br的电子亲和能大小变化如图所示。砷的电子亲和能“突变”的主要原因是_________________________________。

(4)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。配位原子提供孤电子对的能力与元素的电负性大小有关,电负性越大,其原子不容易提供孤电子对,则Fe(CO)5中提供孤电子对的原子是__ (填元素符号);与CO互为等电子体的分子是___________。
(5)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是___________。
(6)氧化镍晶胞如图1所示,单原子层氧化镍的结构如图2所示。

①图1中,原子坐标参数:A(0,0,0)、B(![]() ,0,
,0,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
②图2中,已知氧离子半径为apm(忽略镍离子半径),NA是阿伏加德罗常数的值。每平方米含氧化镍的质量为___________g。(提示:将图2中氧离子切割成正六边形作最小基元)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色,D能发生银镜反应,M与NaOH溶液反应后的产物,其一氯代物只有一种。

已知: (R1、R2表烃基或氢原子)
(R1、R2表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为________、________。
(2)反应①~⑦中,属于消去反应的是________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________________________;反应⑦的化学方程式为______________________________。
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为__________________________________________。
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去乙酸乙酯中残留的乙酸,有效的处理方法是( )
A. 蒸馏 B. 水洗后分液
C. 用过量饱和碳酸钠溶液洗涤后分液 D. 用过量氯化钠溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
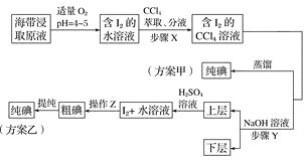
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) ![]() N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42— |
B | 先滴加足量稀硝酸,再滴入AgNO3溶液 | 开始无明显现象,后产生白色沉淀 | 原溶液中有Cl- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com