
| A. | 一定含有I- | B. | 一定含有CO32- | C. | 一定含有NH4+ | D. | 一定含有Na+ |
分析 ①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色,说明生成碘,溶液中含有I-;
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成,说明含有CO32-;
③用铂丝蘸取少量溶液做焰色反应实验,火焰的颜色呈黄色,说明含有Na+,
④加入NaOH溶液并加热,没有任何现象,说明不含NH4+,以此解答该题.
解答 解:①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色,说明生成碘,溶液中含有I-;
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成,说明含有CO32-;
③用铂丝蘸取少量溶液做焰色反应实验,火焰的颜色呈黄色,说明含有Na+,
④加入NaOH溶液并加热,没有任何现象,说明不含NH4+,
题中没有涉及Cl-的检验,Cl-不能确定,只有C正确,
故选C.
点评 本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,明确某些离子的特征反应,如铝离子、铁离子、铵根离子等,本题中根据溶液电中性判断碘离子存在为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
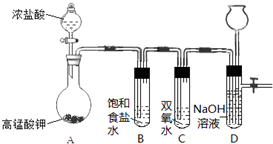 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去).
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
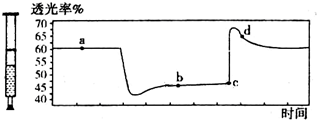 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com