
A、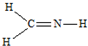 |
B、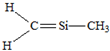 |
C、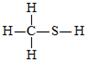 |
D、 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
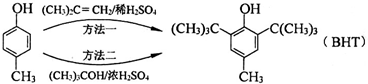
A、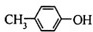 与BHT为同系物 与BHT为同系物 |
B、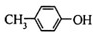 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
| 5 |
| 4 |
| 1 |
| 4 |
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的有机物都很容易燃烧 |
| B、乙烷不能使高锰酸钾溶液褪色 |
| C、符合同一通式的有机物一定互为同系物 |
| D、易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
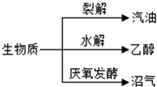 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
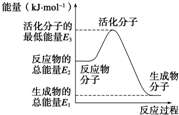 已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1下列说法正确的是( )
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1下列说法正确的是( )| A、反应中的能量变化如图所示,则△H=E1-E3 |
| B、若加入催化剂,将改变反应历程,从而改变△H |
| C、温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D、若保持温度和容器体积不变,充入氦气,则压强增大,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.4g NH3中含有N-H键数为0.2NA |
| B、100mL 1mol?L-1氨水中,含有OH-离子数为0.1NA |
| C、100mL 2mol?L-1碳酸钠溶液中,Na+离子数为0.4NA |
| D、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、已知室温时,0.1mol?L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com