
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用于航天员的供氧剂 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠能和稀盐酸反应但碳酸钠碱性较强,不能用于治疗胃病;
B.过氧化钠具有漂白性,且过氧化钠和水反应生成NaOH导致其溶液呈碱性,无色酚酞试液遇碱变红色;
C.常温下,钠和氧气反应生成氧化钠,加热条件下钠和氧气反应生成过氧化钠;钠极易和空气中氧气、水反应,和煤油不反应且密度大于煤油;
D.过氧化钠和二氧化碳、水反应生成氧气.
解答 解:A.碳酸钠能和稀盐酸反应生成氯化钠、二氧化碳和水,但碳酸钠碱性较强,能腐蚀胃,所以不能用于治疗胃病,所以I错误,故A不选;
B.过氧化钠具有漂白性,且过氧化钠和水反应生成NaOH导致其溶液呈碱性,无色酚酞试液遇碱变红色,所以I中看到的现象是先变红色后褪色,则I错误,故B不选;
C.常温下,钠和氧气反应生成氧化钠,加热条件下钠和氧气反应生成过氧化钠;钠极易和空气中氧气、水反应,和煤油不反应且密度大于煤油,所以I正确、II错误,故C不选;
D.过氧化钠和二氧化碳、水反应生成氧气,氧气能供给呼吸,所以I、II正确,故D选;
故选D.
点评 本题考查实验方案评价,为高频考点,明确物质性质是解本题关键,易错选项是B,注意过氧化钠具有漂白性,为易错点.


科目:高中化学 来源: 题型:解答题
 某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是饱和NaHCO3浓溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 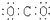 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
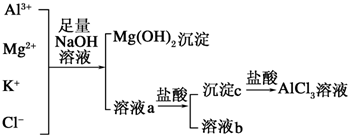
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤纸上有Ag,Cu,Fe滤液中有Fe2+,Mg2+ | |
| B. | 滤纸上有Ag,滤液中有Fe2+,Cu2+,Mg2+,Ag+ | |
| C. | 滤纸上有Ag,Cu,滤液中有Fe2+,Cu2+,Mg2+ | |
| D. | 滤纸上有Ag,Cu,滤液中有Fe2+,Cu2+,Mg2+,Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com