
【题目】下列叙述正确的是( )
A. pH值小于7的雨水称为酸雨
B. 所有金属元素都可以用焰色反应来鉴别
C. 利用丁达尔效应可以区分溶液和胶体
D. 水泥、玻璃、光导纤维的主要成分都属于硅酸盐制品
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该反应中的氧化剂与还原剂的物质的量之比是 .
(2)如反应中转移了2mol电子,则产生的Cl2在标准状况下的体积为多少?
(3)产生的KCl若配成1L的溶液,其物质的量浓度应为多少?
<注:第(2)、(3)小题必须写出计算过程>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于羟基和氢氧根的说法中,不正确的是( )
A. 羟基比氢氧根少一个电子
B. 两者的组成元素相同
C. 羟基不带电,氢氧根带一个单位负电荷
D. 羟基比氢氧根稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用 Na2CO3和 KHCO3 组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)下列有关的说法中,正确的是( )
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
A.盐酸的物质的量浓度为 2 molL﹣1
B.原混合物样品中 n(Na2CO3):n(KHCO3)=1:1
C.实验②中,混合物过量
D.实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是某硫酸试剂瓶标签上的内容: 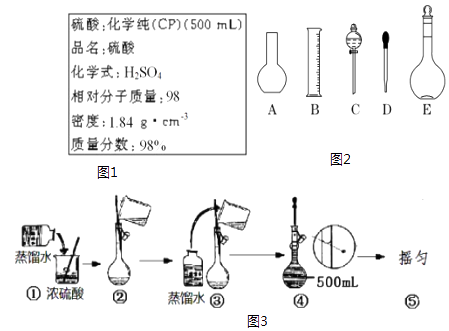
(1)该硫酸的物质的量浓度是mol/L.
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490mL 4.6mol/L的稀硫酸,则要量取该硫酸的体积为mL.
(3)按题(2)的要求配制溶液时,图2中肯定不需要用到的实验仪器是(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要(填仪器名称).
(4)在图3配制过程示意图中,有错误的是(填写序号) .
(5)在配制4.6mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 .
A.未经冷却趁热将溶液注入容量瓶中
B.容量瓶洗涤后,未经干燥处理
C.定容时仰视观察液面
D.摇匀后发现液面低于刻度线继续加水定容
(6)用配制好的4.6mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液ml.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).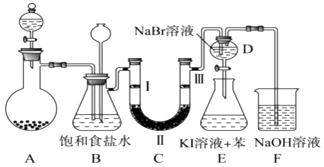
(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为: . 装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 .
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 . (填序号)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D,E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2氧化性Br2(填>、<或=).打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖. 关于青蒿素和双氢青蒿素(结构如图)的下列说法中错误的是( ) 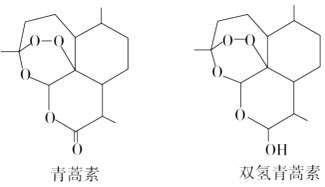
A.双氢青蒿素的分子式为 C15H24O5
B.双氢青蒿素分子中有2个六元环和2个七元环
C.青蒿素分子中含有过氧键、酯基和醚键
D.由青蒿素制备双氢青蒿素的反应属于还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示: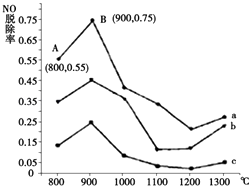
①用化学反应方程式表示NH3消除NO的反应原理(不用注明反应条件).
②曲线b 对应NH3与NO的物质的量之比是 .
③曲线a中,NO的起始浓度为6×10﹣4mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为 mg/(m3s).
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3 , 若吸收的溶液中NO2﹣的浓度为agL﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 至少需通入标准状况下的O2L.(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4 .
①NaHSO3溶液中离子浓度大小为 .
②写出生成S2O42﹣的电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使相同体积的NaCl、CaCl2、AlCl3溶液中的Cl﹣全部沉淀,用去同浓度的AgNO3溶液的体积分别为3V、2V、V,则NaCl、CaCl2、AlCl3溶液的物质的量浓度之比为( )
A.6:3:2
B.3:2:1
C.9:3:1
D.1:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com