
| A. | 中子数为18的硫原子:1816S | B. | HClO的结构式为:H-O-Cl | ||
| C. | H2O2的电子式: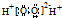 | D. | 聚乙烯的结构简式: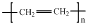 |
分析 A.质量数=质子数+中子数,元素符号的左上角数字为质量数;
B.次氯酸的中心原子为O原子,分子中含有1个氢氧键和1个O-Cl键;
C.双氧水为共价化合物,分子中不存在阴阳离子;
D.聚乙烯为乙烯的加聚反应产物,化学式中不存在碳碳双键.
解答 解:A.中子数为18的硫原子的质量数为34,该原子正确的表示方法为:3416S,故A错误;
B.HClO分子中含有1个氢氧键和1个O-Cl键,其结构式为:H-O-Cl,故B正确;
C.H2O2分子为共价化合物,电子式中不存在括号和电荷,H2O2分子的电子式为 ,故C错误;
,故C错误;
D.乙烯通过加聚反应生成聚乙烯,聚乙烯正确的结构简式为: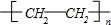 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构简式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
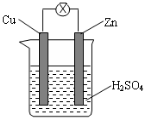
| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子:$\underset{\stackrel{••}{Cl}}{••}$• | B. | 硫离子:$\underset{\stackrel{••}{S}}{••}$:2- | C. | 溴离子[:$\underset{\stackrel{••}{Br}}{••}$:]- | D. | 钙离子Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中的溶质只有NH4Cl | |
| B. | 当溶液呈碱性时:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 该溶液可能由pH=12的氨水与pH=2的HCl溶液等体积混合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
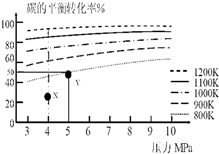
| A. | 上述正反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{{V}^{2}}{{a}^{2}}$L2•mol-2 | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
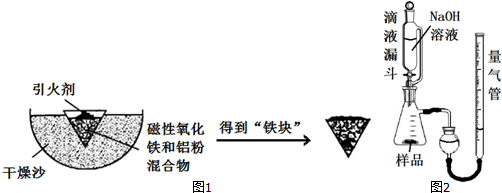

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com