
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | MnO2为该电池的负极 |
|
| C. | 正极反应为:Zn﹣2e﹣=Zn2+ |
|
| D. | 该电池放电时化学能转换为电能 |
考点:
常见化学电源的种类及其工作原理.
分析:
根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn﹣2e﹣+2OH﹣═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e﹣═Mn2O3(s)+2OH﹣(aq),以此解答该题.
解答:
解:A、根据总反应可知Zn被氧化,即电池工作时,锌失去电子,故A正确;
B、根据总反应可知,MnO2中Mn元素的化合价降低,得电子,作该电池的正极,故B错误;
C、MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e﹣═Mn2O3(s)+2OH﹣(aq),故C错误;
D、原电池是把化学能转化为电能的装置,则该电池放电时化学能转换为电能,故D正确.
故选BC.
点评:
本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和原电池正负极的判断.


科目:高中化学 来源: 题型:
Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
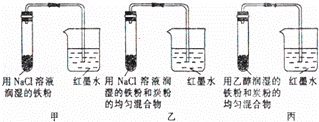
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是 .
(2)通过甲、乙装置的对比说明钢铁中碳的含量越 (填“高”或“低”)钢铁越易腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为 .
Ⅱ.利用化学反应:2FeCl3+Cu═2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池.可供选择的电极材料:铁棒、铜棒、石墨棒.可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液.
请填写下列空白:
(1)选择 作正极材料, 作负极材料;选择 作电解质溶液.
(2)写出有关的电极反应式:正极: ;负极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是下列物质中的一种,这种物质是( )
|
| A. | NaOH | B. | NaClO | C. | KMnO4 | D. | Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试剂的保存方式不正确的是( )
|
| A. | 金属钠保存在煤油中 |
|
| B. | HF溶液保存在棕色玻璃瓶中 |
|
| C. | 浓硫酸盛放在铝制容器中 |
|
| D. | 稀NaOH溶液保存在带橡胶塞的玻璃中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,NaCl溶解于水的实验数据如下表所( )
| 实验序号 | 加入水的质量/g | NaCl质量/g | 未溶的NaCl质量/g |
| ① | 10 | 4 | 2 |
| ② | 20 | 4 | 0 |
| ③ | 30 | 4 | 0 |
|
| A. | 实验①所得溶液为饱和溶液 |
|
| B. | 实验②所得溶液为饱和溶液 |
|
| C. | 20℃时NaCl的溶解度为2g |
|
| D. | 实验③所得溶液的溶质质量分数为13.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中遇到的某些问题常常涉及到化学知识,下列叙述不正确的是( )
|
| A. | 苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用 |
|
| B. | 工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目失明 |
|
| C. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 |
|
| D. | 误食铜盐后,立即喝鸡蛋清解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属原子在二维空间里的放置如图所示的两种方式,下列说法中正确的是( )

|
| A. | 图(a)为非密置层,配位数为6 |
|
| B. | 图(b)为密置层,配位数为4 |
|
| C. | 图(a)在三维空间里堆积可得六方最密堆积和面心立方最密堆积 |
|
| D. | 图(b)在三维空间里堆积仅得简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为 熔化时不需破坏化学键的是 ,熔化时只需破坏共价键的是 (填序号).
(2)在①H2、②(NH4)2SO4、③SiC、④CO2、⑤HF中,由极性键形成的非极性分子有 ,由非极性键形成的非极性分子有 ,能形成分子晶体的物质是 ,含有氢键的晶体的化学式是 ,属于离子晶体的是 ,属于原子晶体的是 .(填序号)
(3)如图表示一些晶体的结构中的某一部分.
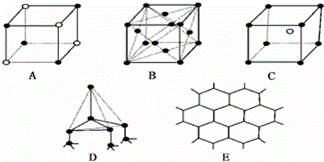
①代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等.
②代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个.
③代表CsCl的是 ,每个Cs+与 个Cl﹣紧邻.
④代表干冰的是 ,每个CO2分子与 个CO2分子紧邻.
⑤代表石墨的是 ,它属于 晶体.
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
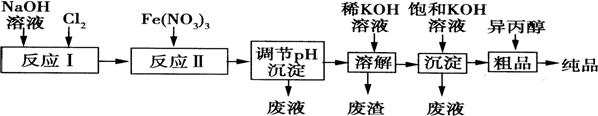
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com