
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
I、(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的方程式_______________。联氨与盐酸反应生成的正盐的化学方程式为__________________
II、某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液(实验装置如上图所示)
(1)配制30%NaOH溶液时,所需的玻璃仪器除量筒外,还有________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
实验二:制取水合肼(实验装置如右图所示)。

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是__________________________________________________
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5 左右。(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(3)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_____________________。
(4)本实验用____________做指示剂,当滴定达到终点时的现象为_____________________。
(5)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
【答案】 ![]() N2H4+H2O
N2H4+H2O![]() N2H
N2H![]() +OH- N2H4+2HCl=N2H6Cl2 BD B 如果将氢氧化钠和次氯酸钠的混合溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化 NaHCO3会与滴定过程中产生的HI反应 淀粉溶液 溶液由无色变为浅蓝色并在半分钟内不褪色 9%
+OH- N2H4+2HCl=N2H6Cl2 BD B 如果将氢氧化钠和次氯酸钠的混合溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化 NaHCO3会与滴定过程中产生的HI反应 淀粉溶液 溶液由无色变为浅蓝色并在半分钟内不褪色 9%
【解析】本题主要考查肼的制法。
I、(1)联氨分子的电子式为![]() 。
。
(2)联氨第一步电离反应的方程式:N2H4+H2O![]() N2H
N2H![]() +OH-。联氨与盐酸反应生成正盐的化学方程式为N2H4+2HCl=N2H6Cl2。
+OH-。联氨与盐酸反应生成正盐的化学方程式为N2H4+2HCl=N2H6Cl2。
II、(1)配制30%NaOH溶液时,所需的玻璃仪器除量筒外,还有BD。
(2)分液漏斗中的溶液是B。选择的理由是如果将氢氧化钠和次氯酸钠的混合溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化。
(3)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是NaHCO3会与滴定过程中产生的HI反应。
(4)本实验用淀粉溶液做指示剂,当滴定达到终点时少量过量的I2遇淀粉变蓝,现象为溶液由无色变为浅蓝色并在半分钟内不褪色。
(5)N2H4·H2O~2I2,馏分中水合肼(N2H4·H2O)的质量分数为0.1000 mol·L-1×18.00 mL/2×10×50g/mol/5.000g=9%。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是.( )

A. 若直流电源 a 为负极,b 为正极,关闭 K2 ,打开 K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒
B. 关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴 入酚酞,发现左侧试管内溶液变红色,则 a 为负极,b 为正极
C. 若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多则a为正极,b为负极
D. 若直流电源 a 为负极,b 为正极,关闭 K2,打开 K1,一段时间后,再关闭 K1,打开 K2,则左 侧石墨棒上发生的电极反应为 H2﹣2e﹣+2OH﹣═2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)![]() 2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是( )
2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是( )

A. 若把2molX和1 molY充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应
B. 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol
C. 反应达到平衡后,再将2molX和1 molY充入该容器中,则反应速率V与时间t关系图如图2所示
D. 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯塑料在生产、生活中有广泛应用,其单体可由乙苯和二氧化碳在一定条件下反应制得,其反应原理如下:
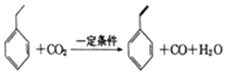
下列有关说法不正确的是
A. 苯乙烯可通过加聚反生成聚苯乙烯
B. 苯乙烯分子中所有原子可能共平面
C. 乙苯、苯乙烯均能使溴水褪色,且其褪色原理相同
D. 等质量的聚苯乙烯与苯乙烯中所含的碳原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达不正确的是
A. 体积②>③>①>④ B. 密度②>③>④>①
C. 质量②>③>①>④ D. 氢原子个数③>①>②>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)该混合气体中CO和CO2的物质的量之比为_________。
(3)混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(4)将混合气体依次通过如下图所示装置,最后收集在气球中(体积在标准状况下测定)。

①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列实验操作或事故处理方法:① 用50 mL量筒量取5.0 mL硫酸铜溶液;② 称量没有腐蚀性固体药品时,把药品放在托盘上称量;③ 氢氧化钠浓溶液不慎溅入眼中,应立即用大量水冲洗,并且边洗边眨眼睛;④ 倾倒液体时,试剂瓶的瓶口不对准容器口;⑤ 块状药品都要用药匙取用;⑥ 固体药品用细口瓶保存;⑦ 用下图所示的方法闻气体的气味;⑧ 在实验中不慎手被玻璃划破,可用碘酒或双氧水清洗后,再用药外敷;⑨ 煤气中毒的人,立即进行人工呼吸;⑩ 浓H2SO4溅到皮肤上,用NaOH溶液中和。其中错误的是( )
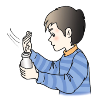
A. ①②③⑦⑨⑩ B. ③④⑩ C. ②⑤⑥⑦⑩ D. ①②④⑤⑥⑨⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com