
分析 (1)生成的气体为二氧化碳,根据碳原子守恒计算碳酸氢钠的物质的量,进而计算氢氧化钠的质量分数;
(2)全部为碳酸氢钠时消耗HCl最少,此时消耗n(HCl)=n(NaHCO3)=$\frac{10.4g}{84g/mol}$=0.124mol>0.1L×1.00mol/L=0.1mol,故HCl不足,HCl完全反应生成NaCl,由于生成二氧化碳,故NaOH完全反应,生成的二氧化碳为1.12L,根据碳原子守恒计算参加反应碳酸氢钠的物质的量,结合钠离子、氯离子守恒计算NaOH的物质的量,进而计算碳酸氢钠的质量;
(3)①当x=1时,发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,x>1时NaOH有剩余,NaOH与NaHCO31:1恰好完全反应时,固体质量减小为最大值;
②x<1时,发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,NaOH与NaHCO31:1恰好完全反应时,固体质量减小为极小值.
解答 解:(1)生成的气体为二氧化碳,根据碳原子守恒:n(NaHCO3)=n(CO2)=$\frac{V}{22.4}$mol,则NaOH的质量为10.4g-$\frac{V}{22.4}$mol×84g/mol=(10.4-$\frac{V}{22.4}$×84)g,故NaOH的质量分数为$\frac{(10.4-\frac{V}{22.4}×84)g}{10.4g}$×100%=$\frac{10.4-84×\frac{V}{22.4}}{10.4}$×100%,
故答案为:$\frac{10.4-84×\frac{V}{22.4}}{10.4}$×100%;
(2)全部为碳酸氢钠时消耗HCl最少,此时消耗n(HCl)=n(NaHCO3)=$\frac{10.4g}{84g/mol}$=0.124mol>0.1L×1.00mol/L=0.1mol,故HCl不足,HCl完全反应生成NaCl,由于生成二氧化碳,故NaOH完全反应,生成的二氧化碳为$\frac{1.12L}{22.4L/mol}$=0.0500mol,根据碳原子守恒,参加反应碳酸氢钠的物质的量为0.0500mol,结合钠离子、氯离子守恒可知n(NaOH)=n(NaCl)-n反应(NaHCO3)=n(HCl)-n反应(NaHCO3)=0.1mol-0.05mol=0.0500mol,则m (NaHCO3)=10.4g-0.05mol×40g/mol=8.40g,
故答案为:0.0500mol;8.40g;
(3)①当x=1时,发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,x>1时NaOH有剩余,NaOH与NaHCO31:1恰好完全反应时,固体质量减小为最大值,则n(NaOH)=$\frac{10.4g}{40g/mol+84g/mol}$=$\frac{10.4}{124}$mol,故生成的水为=$\frac{10.4}{124}$mol×18g/mol=1.51g,故x≥1时,m≤1.15g,
故答案为:≤1.51g;
②x<1时,发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,NaOH与NaHCO31:1恰好完全反应时,固体质量减小为极小值,故x<1时,m>1.51g,
故答案为:>1.51g.
点评 本题考查混合物计算、讨论计算等,侧重考查学生分析计算能力,(2)属于易错题目,关键是利用极限法判断盐酸不足,氢氧化钠完全反应.


科目:高中化学 来源: 题型:多选题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pt为负极,Zn为正极 | |
| B. | Zn为负极,Pt为正极 | |
| C. | 负极反应式为Zn-2e-═Zn2+,正极反应式为2H++2e-═H2↑ | |
| D. | 负极反应式为Zn-2e-═Zn2+,正极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苹果酸的分子式为C4H8O5 | |
| B. | 苹果酸能与Na、NaOH反应,但不能与NaHCO3反应 | |
| C. | 苹果酸既能发生酯化反应,又能缩聚成高分子化合物 | |
| D. | 2分子苹果酸相互反应可形成两种环状的酯类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M1病毒中的C、H、O、N、S元素最有可能以共价键结合 | |
| B. | M1病毒在高温下也具有生物活性 | |
| C. | M1病毒溶液能产生丁达尔效应 | |
| D. | M1病毒在生物体内水解的终产物中含有氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
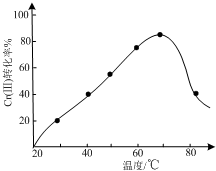 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
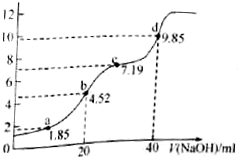 已知:pKa=-LgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19.用0.1mol/L NaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-LgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19.用0.1mol/L NaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 mol/L | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | C点所得溶液中:2c(Na+)=3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com