
| A. | 液态溴化氢 | B. | 液氨 | C. | 铝 | D. | 稀硝酸 |
科目:高中化学 来源: 题型:解答题

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
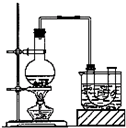 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、CH3COO- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2CO3的溶液:K+、Ca2+、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
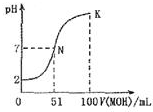 常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是
常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是| A. | MOH为一元弱碱 | |
| B. | MA 稀溶液PH<7 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液的PH=10,则C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
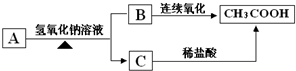
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
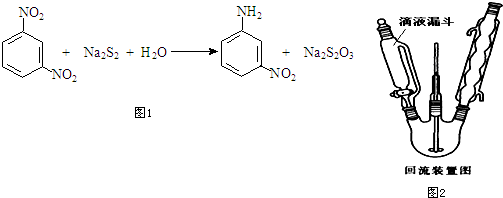
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com