
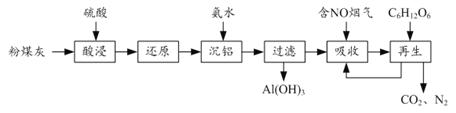
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
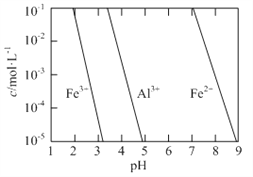
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
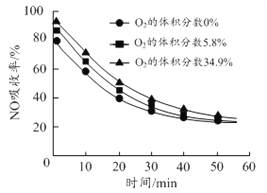
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。
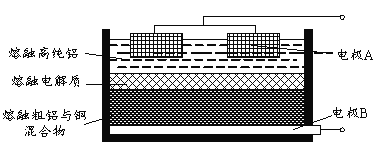
①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
【答案】 Al2O3+6H+=2Al3++3H2O 生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解 Fe3+完全沉淀与Al3+开始沉淀的pH相近 增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间 C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
【解析】(1)①“酸浸”时,粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中的Al2O3、Fe2O3、CaCO3被硫酸溶解,其中Al2O3发生反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
②硫酸钙微溶于水。当硫酸质量分数大于50%,生成的硫酸钙覆盖在固体反应物表面,阻止铁、铝氧化物的溶解,使得金属氧化物浸出率明显下降,故答案为:生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解;
(2)根据金属离子以氢氧化物沉淀时离子浓度随pH变化图像,Fe3+完全沉淀与Al3+开始沉淀的pH相近,导致浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差,故答案为:Fe3+完全沉淀与Al3+开始沉淀的pH相近;
(3)①FeSO4溶液吸收NO的原理为Fe2++2NO![]() [Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
[Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应生成二氧化碳和氮气,反应的离子方程式为C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+
6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O;
6Fe2++ 6N2↑+ 6CO2↑+6H2O;
(4)①根据电解目的,要将粗铝通过电解得到高纯铝,需要将粗铝作阳极,高纯铝作阴极,该装置工作时,电极A作阴极,故答案为:阴;
②熔融粗铝时加入铜可以增大阳极熔融物的密度,使之在最下层,故答案为:增大阳极熔融物的密度。


科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
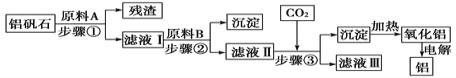
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
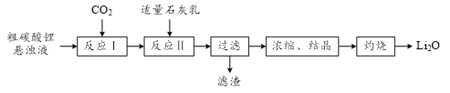
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
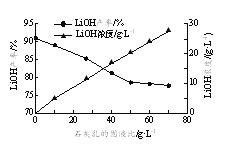
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:
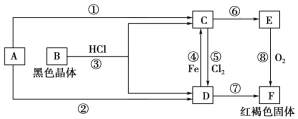
下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
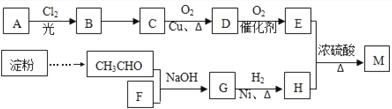
已知:I.烃A的相对分子质量为72,且分子中只有一种氢原子;B分子中核磁共振氢谱有2个峰,且面积比为9:2;35%-40%的F的水溶液被称为福尔马林。
II.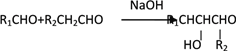
(1)A的名称为____________________(系统命名法),B的结构简式为_____________________,F的分子式为_____________。
(2)B→C的反应条件是___________________,G的官能团名称是________________________。
(3)D与银氨溶液反应的化学方程式为_________________________________________________。
(4)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
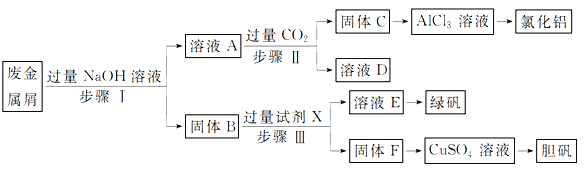
请回答:
(1)写出步骤Ⅰ反应的离子方程式:____________________________。
(2)试剂X是______________。溶液D是______________。
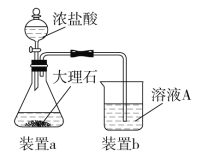
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如下:

①测得溶液E中c(Fe2+)为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液_______kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式______________。(已知NaClO还原为NaCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
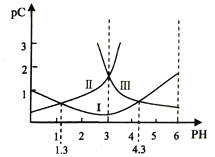
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com