
【题目】卤代烯烃是合成塑料的重要原料,研究合成卤代烯烃具有重要意义。T℃时,在10 L的密闭容器中充入1mol 2-丁炔(CH3-C≡C-CH3,可用X表示)和1molHCl,以Al2O3为催化剂发生如下反应:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
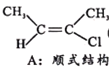 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
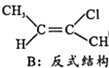 (g) H=bkJ/mol(a<0)
(g) H=bkJ/mol(a<0)
已知B比A更稳定,且产物A、B在混合物中的物质的量随时间变化如图所示。试回答下列问题。

(1)发生反应I、Ⅱ的同时,还有反应A转化为B,且焓变为△H'。则△H' ___0(填“>”、“<”或“=”)。
(2)①从反应开始至20 min时生成B的平均速率v(B)=____;
②反应至20 min时CH3-C≡C-CH3的转化率=____;
③在T℃时,反应I的平衡常数为____。
(3)T℃时,E1和E2分别代表反应I,Ⅱ的正反应活化能。
①由图得出:E1___E2(填“>”、“<”或“=”);
②试从反应方向的角度分析,20 min后A的物质的量减小的原因____
(4)其它条件相同时,测出生成A、B 的速率随温度变化如图所示,则提高B在较低温度下产率的措施是______

【答案】< 1×10-3mol/(Lmin) 60% 100 < B的能量低,A转化为B为放热反应,有利于A自发转化为B 加入低温下适合生成B的高性能催化剂
【解析】
(1)根据盖斯定律计算;
(2)①结合图示,根据v=![]() B的平均速率;
B的平均速率;
②反应I、Ⅱ都在发生,反应至20 min时,根据生成A、B的量根据反应推断CH3-C≡C-CH3的消耗量,转化率=![]() ×100%;
×100%;
③在T℃时,根据图像,根据平衡时各物质的量计算反应I的平衡常数;
(3)①结合图像,根据20min前产物A的量大于B分析;
②根据B比A更稳定,A转化为B为放热反应分析;
(4)其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
(1)已知:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
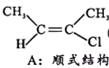 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
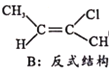 (g) H=bkJ/mol(a<0)
(g) H=bkJ/mol(a<0)
根据盖斯定律,Ⅱ-Ⅰ可得
![]()
 △H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故(b-a)<0,即△H'<0,反应放热;
△H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故(b-a)<0,即△H'<0,反应放热;
(2)①结合图示,从反应开始至20 min时生成B的物质的量为0.2mol,根据v=![]() ,v(B)=
,v(B)=![]() =1×10-3mol/(Lmin);
=1×10-3mol/(Lmin);
②反应I、Ⅱ都在发生,反应至20 min时,根据图像,生成A、B的量分别为0.2mol、0.4mol,根据反应I、Ⅱ可得CH3-C≡C-CH3的消耗量为0.2mol+0.4mol=0.6mol,转化率=![]() ×100%=
×100%=![]() ×100%=60%;
×100%=60%;
③反应I的产物为A,在T℃时,根据图像,平衡时反应I生成A的物质的量为0.1mol,反应Ⅱ生成B的物质的量为0.8mol,则平衡时CH3-C≡C-CH3的物质的量为1mol-0.1mol-0.8=0.1mol,HCl的物质的量为1mol-0.1mol-0.8=0.1mol,反应I平衡常数K=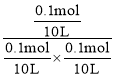 =100;
=100;
(3)①根据图像所示,20 min前,A的产量高于B,说明生成产物A的活化能较低,反应速率快,故E1<E2;
②根据B比A更稳定,说明B的能量低,A转化为B为放热反应,有利于A自发转化为B;
(4)相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,其它条件相同时,催化剂对反应I、Ⅱ生成A、B的催化效果不同,提高B在较低温度下产率的措施应为加入低温下适合生成B的高性能催化剂。


科目:高中化学 来源: 题型:
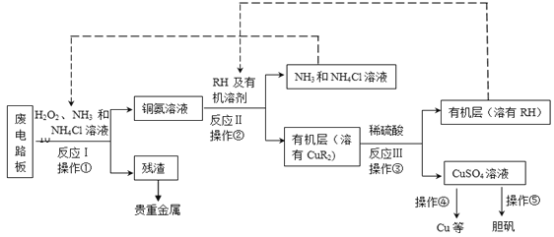
【题目】(18分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
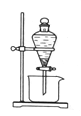
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用下图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]()
B. Na+的结构示意图:![]()
C. Ge的电子排布式:[Ar]3d104s24p2
D. Cu+的价电子排布式:3d10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N分子的模型如图所示,其中不同颜色的球表示不同的原子,原子之间的化学键可以是单键、双键。下列说法错误的是
M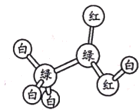 N
N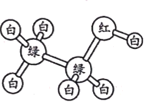
A.M与HCOOCH3互为同分异构体
B.N的官能团为羟基
C.在与钠的反应中N放出气泡比M快
D.N能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列溶液的分析正确的是
A.常温下pH=12的NaOH溶液,升高温度,其pH增大
B.向0.1mol/L NaHSO3溶液通入氨气至中性时![]()
C.0.01 mol/L醋酸溶液加水稀释时,原溶液中水的电离程度增大
D.在常温下,向二元弱酸的盐NaHA溶液中加入少量NaOH固体![]() 将增大
将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2(g)+I2(g)![]() 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g)![]() H(g)+CO(g),碳的质量不再改变说明反应已达平衡
H(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若在恒温恒容容器内,压强不再随时间变化能说明反应2A(?)+B(g)![]() 2C(?)已达平衡,则A、C不能同时是气体
2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是一种急性剧毒气体,回收硫化氢解决了环境污染问题也可变废为宝。其反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632 kJ·mol-1。在酸性固体电解质环境下,硫化氢的处理原理图如图所示。下列说法正确的是

A.电极a的电极反应式为2H2S-4e-=S2+4H+
B.电子由电极a经质子固体电解质膜流向电极b
C.1 mol的H2S气体完全反应得到固体S2和水蒸气放热316kJ
D.负载中电流的方向自上而下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取 Na2Cr2O7 溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
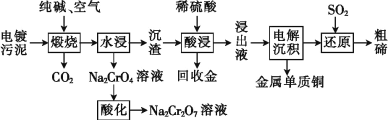
已知:煅烧时,Cu2Te 发生的反应为Cu2Te+2O2 ![]() 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3 发生反应的化学方程式为______。
(2)浸出液中除了含有 TeOSO4(在电解过程中不反应)外,还可能含有_____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
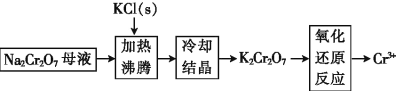
通过冷却结晶能析出大量 K2Cr2O7 的原因是_____。
(4)测定产品中 K2Cr2O7 含量的方法如下:称取产品试样 2.50 g 配成 250 mL 溶液,用移液管取出 25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用 0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2 标准液进行滴定,重复进行二次实验。(已知 Cr2 O72-被还原为 Cr3+)
①氧化还原滴定过程中的离子方程式为_____。
②若三次实验消耗(NH4)2Fe(SO4)2 标准液的平均体积为 25.00 mL,则所得产品中 K2Cr2O7 的纯度为_____%。[已知 M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中 K2Cr2O7 发生氧化还原反应后所得溶液中除含有 Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调 pH 的方法使两者转化为沉淀。已知 c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出 Cr(OH)3 沉淀时Fe3+是否沉淀完全______(填“是”或“否”),写出计算过程________________(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
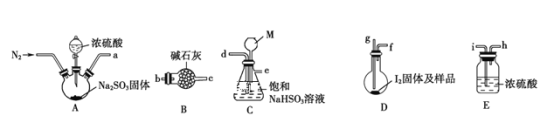
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com