
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
【答案】D
【解析】A.加水稀释促进硫化氢电离,但氢离子浓度减小,选项A错误;B. 加入20ml浓度为0.1mol/L NaOH溶液,得到硫化钠溶液,根据物料守恒有c(Na+)=2c(HS-)+2c(H2S)+2c(S2-),选项B错误;C、通入过量SO2气体,二氧化硫与硫化氢反应生成硫和水,平衡向左移动,开始时溶液pH值增大,后当二氧化硫过量时生成亚硫酸则pH值减小,选项C错误;D、加入10ml浓度为0.1mol/L NaOH溶液,NaHS溶液,溶液呈碱性,则HS-水解大于电离,离子浓度大小为c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-),选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图________________; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②SO42-的空间构型为_____________,SO32-离子中心原子的杂化方式为__________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 丙烷的二氯取代物有3种
B. ![]() 和苯乙烯互为同系物
和苯乙烯互为同系物
C. 饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同
D. 聚合物(![]() )可由单体CH3CH=CH2和CH2=CH2加聚制得
)可由单体CH3CH=CH2和CH2=CH2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BC13的沸点为12.5 ℃ ,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:
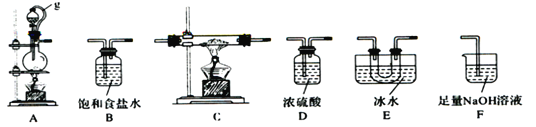
(1)A中反应的离子方程式为__________________。
(2)图中g管的作用是______________________________________。
(3)装置的连接顺序依次为A→ → → →E→D→F;____________在E、F装置间连接D装置的作用是____________________________________________________________。
(4)停止实验时,正确的实验操作是______________________________________________________________________________________________________________。
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为_____(填“正盐”或“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红 溶液 | 现象 |
① | 5.0 | 0 | 0 | x | 4滴 | 较快褪色 |
② | 0 | 5.0 | 5.0 | 0 | 4滴 | 不褪色 |
③ | 5.0 | 0 | 5.0 | 0 | 4滴 | 缓慢褪色 |
则x=_______,结论:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道表示式为_______。
(2)AlH4-的空间构型为_______________,中心原子Al的轨道杂化方式为________;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为________________(标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于____晶体,其电子式为_____________。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为________g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为__________(填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:
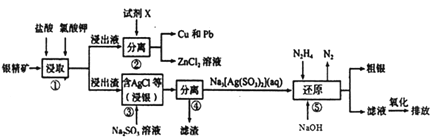
(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________(写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______。
(3)步骤③发生反应的化学方程式为____________________。
(4)步骤⑤发生反应的离子方程式为____________________;其中N2H4(肼) 的电子式为____。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______。
(6) 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____mol/L (不用化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com