
25 ℃,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离出的c(OH-)分别是:
①NaOH溶液中___________________________________________________;
②Na2CO3溶液中__________________________________________________;
③在1 L水中加入上述溶液中的________会使水的电离程度减小。
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是________(填化学式)溶液。
(3)纯碱溶液呈碱性的原因是(用离子方程式表示_____________________。
(4)为探究纯碱溶液呈碱性是由CO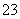 水解引起的,请你设计一个简单的实验方案。
水解引起的,请你设计一个简单的实验方案。
解析 (1)①NaOH能抑制水的电离,NaOH溶液中的H+来自于水的电离,
c(H+)水=c(OH-)水=1.0×10-11 mol·L-1;②Na2CO3水解能促进水的电离,其溶液中的OH-来自于水的电离,即c(OH-)=1.0×10-3 mol·L-1;③NaOH电离的OH-会抑制水的电离。(2)加水稀释时,因为CO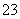 的水解程度增大,所以pH变化小,pH变化较大的是NaOH溶液。
的水解程度增大,所以pH变化小,pH变化较大的是NaOH溶液。
答案 (1)①1.0×10-11 mol·L-1 ②1.0×10-3 mol·L-1 ③NaOH溶液 (2)NaOH
(3)CO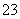 +H2OHCO
+H2OHCO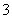 +OH-
+OH-
(4)向纯碱溶液中滴入酚酞试液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,则可以说明纯碱溶液呈碱性是由CO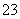 水解引起的(或其他合理答案)
水解引起的(或其他合理答案)


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是( )
|
| A. | H2O、NH3•H2O、H3PO4、HF |
|
| B. | Cu(OH)2、CH3COOH、C2H5OH、CH3COONa |
|
| C. | H2SO3、Ba(OH)2、BaSO4 Fe |
|
| D. | H2SiO3、H2S、CO2 NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是 ( )
A. n=m+10 B. n=m+11
C. n=m+25 D. n=m+1
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH )由大到小排列正确的是 ( )。
)由大到小排列正确的是 ( )。
A.②③④① B.②①③④
C.③②④① D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)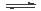 CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
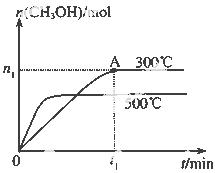
(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_________ 。(填字母)
A.缩小容器体积 B.降低温度
C.升高温度 D.使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
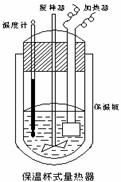 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
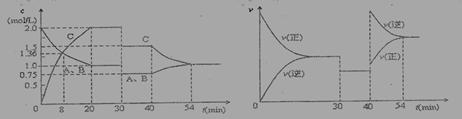
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险.由于人体体液的缓冲系统中存在如下平衡:
H++HCO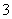
 H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO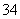
 HPO
HPO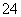
H++HPO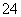
 H2PO
H2PO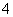
故能维持血液pH的相对稳定,以保证正常生理活动.下列说法中不合理的是 ( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com