
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):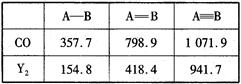
①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。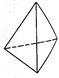
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
(1)1s22s22p63s23p4 (1分)
(2)HNO3、NH3·H2O 、NH4NO3 (3分) 平面三角形 (2分) sp2 (1分)
(3)O>S或S<O (1分) N>O 或O<N (1分)
(4)①断裂第一个π键消耗能量:CO 273kJ·mol-1< N2 523.3kJ·mol-1,CO中第一个π键更容易断裂,故CO比N2活泼 (3分) ② B、D (3分)
解析试题分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为氢元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为 ,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素。
,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素。
(1)W为S元素,S原子的电子排布式为: 1s22s22p63s23p4 。
(2)H、N、O三种元素组成的三种常见物质,分别属于酸、碱、盐,为HNO3、NH3·H2O 、NH4NO3;NO3?中N原子作为中心原子提供5个电子,当第VIA族的元素O作为周围原子时,不提供电子,NO3?有一个负电荷,多1个电子,所以价电子一共6个,即3对。所以没有孤对电子,空间构型为平面三角形,中心原子杂化方式为sp2。
(3)O、S元素位于同主族,电负性O>S;第一电离能N>O。
(4)①CO断裂第一个π键消耗能量为1071.9kJ?mol?1-798.9kJ?mol?1=273kJ·mol-1, N2断裂第一个π键消耗能量为941.7 kJ?mol?1-418.4kJ?mol?1=523.3kJ·mol-1,CO中第一个π键更容易断裂,故CO比N2活泼。
②A、N4为单质,错误;B、N4与N2是N元素组成的结构和性质不同的单质,互为同素异形体,正确;C、N4与P4为结构相似的分子晶体,相对分子质量越大,范德华力越大,所以沸点N4<P4,错误;D、1 mol N4气体转变为N2放出的热量为:2mol×941.7kJ?mol?1-6mol×154.8kJ?mol?1=954.6kJ。
考点:本题考查元素的推断、电子排布式的书写、空间构型和杂化方式、电负性和第一电离能的比较、物质的稳定性比较、化学反应热效应的计算。


科目:高中化学 来源: 题型:单选题
下列叙述错误的是( )
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知X、Y是阳离子,Z是阴离子,M、N是分子,它们都由短周期元素组成,且具有
以下结构特征和性质:
①X、Y、M、N的核外电子总数相等;②常温下,M是极易溶于N的气体;③X与M均由相同的元素组成;④Y为单核离子,其与Z组成的物质可用于净水;⑤Z由同主族元素组成。请回答下列问题:
(1)X的电子式为 ,Z的离子符号为 。
(2)X与Z形成的化合物中所含有的化学键类型为 。
(3)写出Y与M、N形成的混合物发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
①NaCl溶于水时破坏___________________________________;
②HCl溶于水时破坏____________________________________;
③SO2溶于水时破坏____________________________________;
④酒精溶于水时破坏____________________________________;
⑤NaOH和HCl反应时形成_______和_______;
⑥反应2H2+O22H2O中,被破坏的是________,形成的是________;
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
⑧Na2O熔化时被破坏的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1919年,langmuir提出等电子原理:原子数相同、最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:________和________;________和________。
(2)此后,等电子原理又有发展。例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有:__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛.
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为________,其空间构型是________型,由此可见它是________分子(填“极性”或“非极性”)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2)∶2CHCl3+O2→2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是________.
| A.酚酞试液 | B.淀粉碘化钾溶液 | C.NaOH溶液 | D.硝酸银稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金属原子在二维空间里的放置有如图所示的两种方式,下列说法中正确的是( )
| A.图a为非密置层,配位数为6 |
| B.图b为密置层,配位数为4 |
| C.图a在三堆空间里堆积可得六方最密堆积和面心立方最密堆积 |
| D.图b在三维空间里堆积仅得简单立方堆积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com