
【题目】草酸亚铁(FeC2O4)作为一种化工原料,可广泛用于新型电池材料、感光材料的生产。以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:

(1)如图是反应温度、加料时间及分散剂的质量分数对草酸亚铁纯度的影响:
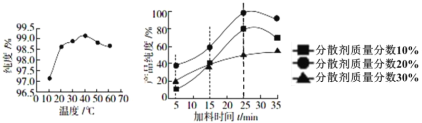
从图象可知,制备电池级草酸亚铁晶体的最佳实验条件是_____________________________
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式______________________
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为___________________________。
(4)流程图中“滤液”经处理后得到一种化肥,其化学式为_________。“一系列操作”指___________。
(5)草酸亚铁固体纯度的测定
①准确称取m g草酸亚铁固体样品,溶于30 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液。
②取20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)消耗V1mL。
③向滴定后的溶液中加入适量锌粉,用试剂x检验Fe3+至极微量,过滤,洗涤,洗涤液并入滤液中。
④继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,消耗V2mL。
在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应,写出其离子方程式_____________,步骤③中检验其中微量的Fe3+的试剂x名称是_________溶液,固体样品的纯度为_____________(用含c、V1、V2的式子表示)
【答案】温度40℃,加料时间25min,分散剂质量分数20% Fe + 2Fe3+ = 3Fe2+ TiOSO4 + 2H2O![]() TiO2·H2O↓ + H2SO4 (NH4)2SO4 洗涤干燥 MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O KSCN
TiO2·H2O↓ + H2SO4 (NH4)2SO4 洗涤干燥 MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O KSCN ![]()
【解析】
根据图中信息脱硫渣和硫酸反应主要生成硫酸铁,过滤,向滤液中加入足量铁粉,与硫酸铁反应,过滤,滤渣主要是过量铁粉和TiOSO4,再向滤液中加入氨水生成氢氧化亚铁和硫酸铵,滤液中主要是硫酸铵,向氢氧化亚铁中加入草酸和乙醇,过滤,经过一系列最终得到草酸亚铁晶体。
(1)根据图像信息可知40℃纯度最高,加料时间在25min产品纯度最高,分散剂质量分数20%时产品纯度最高,因此制备电池级草酸亚铁晶体的最佳实验条件是温度40℃,加料时间25min,分散剂质量分数20%;故答案为:温度40℃,加料时间25min,分散剂质量分数20%。
(2)写出“还原”过程中既是化合反应又是氧化还原反应的是铁和硫酸铁反应生成硫酸亚铁,其离子方程式Fe + 2Fe3+ = 3Fe2+;故答案为:Fe + 2Fe3+ = 3Fe2+。
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为TiOSO4 + 2H2O![]() TiO2·H2O↓+ H2SO4;故答案为:TiOSO4 + 2H2O
TiO2·H2O↓+ H2SO4;故答案为:TiOSO4 + 2H2O![]() TiO2·H2O↓ + H2SO4。
TiO2·H2O↓ + H2SO4。
(4)过量氨水和硫酸亚铁反应生成氢氧化亚铁和硫酸铵,因此流程图中“滤液”经处理后得到一种化肥,其化学式为(NH4)2SO4。 “一系列操作”指是过滤后需要洗涤干燥;故答案为:(NH4)2SO4;洗涤干燥。
(5)在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应是亚铁离子被酸性高锰酸根反应,其离子方程式MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O,步骤③用KSCN溶液检验其中微量的Fe3+,步骤④是亚铁离子消耗高锰酸钾V2 mL,根据MnO4- — 5Fe2+得到n(Fe2+)= 5c mol·L1×V2×103L =5c×V2×103mol,因此固体样品的纯度为![]() ;故答案为:MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O;KSCN;
;故答案为:MnO4-+5Fe2++8H+= Mn2++5Fe3++4H2O;KSCN;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】光气(COCl2)的分解反应为:COCl2(g)![]() Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产符合人类需要的特定性能的物质是化学服务于人类的责任。解热镇痛药水杨酸改进为阿司匹林、缓释阿司匹林、贝诺酯就是最好的实例。下图表示这三种药物的合成:

(1)反应①的条件是____________;物质B含有的官能团名称是________________
(2)已知乙酸酐是2分子乙酸脱去1分子水的产物,写出M的结构简式__________
(3)反应③的类型____________,写出该反应④的一种副产物的结构简式________
(4)水杨酸与足量Na2CO3溶液能发生反应,写出化学方程式____________________
(5)1mol阿司匹林和1mol缓释长效阿司匹林与NaOH溶液充分反应,最多消耗NaOH的物质的量分别是_________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1) 当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=________________________;
(2) 当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=_________,得到的CO和CO2的物质的量之比n(CO):n(CO2)=______________。
(3) a的取值范围是____________________;b的取值范围是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72- +H2O ![]() 2CrO42-+2H+。在装有4mL0.1mol·L-1K2Cr2O7溶液中加入1mol·L-1的NaOH数滴,溶液的颜色由_________色变____________色,平衡常数的表达式是 K= __________________________。
2CrO42-+2H+。在装有4mL0.1mol·L-1K2Cr2O7溶液中加入1mol·L-1的NaOH数滴,溶液的颜色由_________色变____________色,平衡常数的表达式是 K= __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
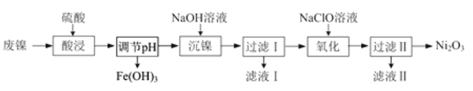
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
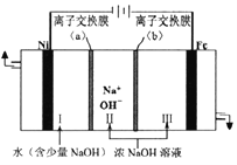
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
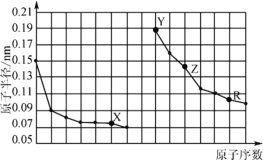
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
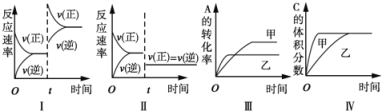
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com