
| A. | 加入Al能放出H2的溶液:K+、Cu2+、NO3-、SO42- | |
| B. | 某无色透明溶液:Fe2+、ClO-、SiO32-、Na + | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+、K+、NO3-、Cl- | |
| D. | 0.1mol/LNaHCO3溶液:Na+、A13+、SO42-、NO3- |
分析 A.该溶液中存在大量氢离子或氢氧根离子,铜离子与氢氧根离子反应,酸性条件下硝酸根离子与铝反应不会生成氢气;
B.亚铁离子为有色离子,亚铁离子与次氯酸根离子、硅酸根离子反应;
C.四种离子之间不反应,都不与碳酸铵反应;
D.碳酸氢钠与铝离子发生双水解反应.
解答 解:A.加入Al能放出H2的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,Cu2+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,故A错误;
B.Fe2+为有色离子,Fe2+与ClO-、SiO32-发生反应,在溶液中不能大量共存,故B错误;
C.Na+、K+、NO3-、Cl-之间不反应,都不与(NH4)2CO3反应,能够共存,故C正确;
D.A13+与NaHCO3发生反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
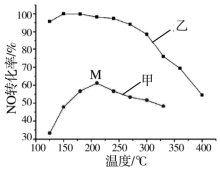 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 生成白色沉淀 | 试样己氧化变质 |
| B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3>Cl2 |
| C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测溶液中含有Fe2+ |
| D | 向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液 | 产生白色沉淀 | Ksp(Ag2SO4)<Ksp(Ag2CO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤的反应类型相同 | B. | ⑥⑦的反应类型不同 | ||
| C. | ④与其他8个反应的类型都不同 | D. | ①③⑧属于同一种反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
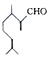 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( 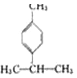 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水反应加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
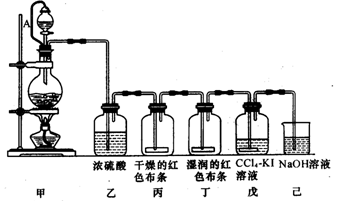

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com