
分析 ①A+Na→产生气泡,可说明A中含有-OH或-COOH;
②A+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$有香味的产物,说明A中含有-OH;
③A+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$有香味的产物,说明中含有-COOH,可知A中既含有-OH又含有-COOH,应为HOCH2COOH,以此解答该题.
解答 解:①A+Na→产生气泡,可说明A中含有-OH或-COOH;
②A+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$有香味的产物,说明A中含有-OH;
③A+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$有香味的产物,说明中含有-COOH,可知A中既含有-OH又含有-COOH,应为HOCH2COOH,
(1)由以上分析可知A为HOCH2COOH,既含有-OH又含有-COOH,故答案为:AB;
(2)A为HOCH2COOH,可与Na反应生成氢气,反应的化学方程式为HOCH2COOH+2Na→NaOCH2COONa+H2↑,故答案为:HOCH2COOH+2Na→NaOCH2COONa+H2↑;
(3)③的化学反应方程式为HOCH2COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$HOCH2COOCH2CH3+H2O,故答案为:HOCH2COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$HOCH2COOCH2CH3+H2O.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质与官能团的判断,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
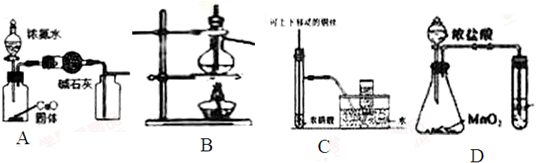
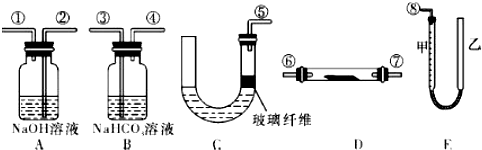
| A. | 制取并收集干燥纯净的NH3 | B. | 分离Br2和CCl4的混合物 | ||
| C. | 用于制备并收集少量NO | D. | 比较MnO2、Cl2、S 的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′>Q | |
| B. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′<Q | |
| C. | 1mol SO2(g)的能量>1mol S(s)的能量+1mol O2(g)的能量 | |
| D. | 1mol SO2(g)的能量<1mol S(s)的能量+1mol O2(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
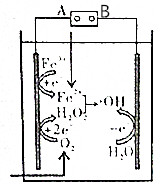 电-Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+•OH,生成的烃基自由基(•OH)能氧化降解有机污染物.下列说法不正确的是( )
电-Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+•OH,生成的烃基自由基(•OH)能氧化降解有机污染物.下列说法不正确的是( )| A. | 电源的A极是负极 | |
| B. | 电解池中只有O2、Fe3+发生还原反应 | |
| C. | 阳极上发生电极反应:H2O-e-=•OH+H+, | |
| D. | 消耗1molO2,可以产生4mol•OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
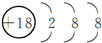 .
.| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com