
部分中学化学常见元素原子结构及性质如下表所示:
序 号 元素 结构及性质
① A 在地壳中的含量居于第三位,单质由电解法制取,其化学性质活泼,但在空气中能稳定存在;其离子半径在同周期中金属离子中最小。
② B B原子最外层电子数是内层电子数的1/5
③ C C单质分子中含化学键数最多,单质稳定,但其原子较活泼
④ D 通常情况下,D没有正化合价,A、B、C、E都能与D化合
⑤ E E在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族
(1)上述元素中,其最高价氧化物对应的水化物呈两性的物质是_____________(填化学式),试用离子反应方程式表示其两性的原因___________________________________________;
_________________________________________________。
(2)B与C简单离子的半径大小为_________________(用离子符号表示)
(3)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,写出一定条件下X与B反应的方程式为 ,E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,请写出M的电子式 ,N的结构式 ___ __
(13分)(1)Al(OH)3;Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH—=AlO2—+2H2O
(2)Mg2+﹤N3—
(3)Mg+2H2O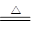 Mg(OH)2+H2↑;
Mg(OH)2+H2↑;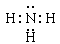 ;
;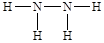 (第一空1分其余都2分)
(第一空1分其余都2分)
【解析】
试题分析:在地壳中的含量居于第三位,则A是Al。B原子最外层电子数是内层电子数的1/5,这说明B应该是第三周期元素,则B是P元素。C单质分子中含化学键数最多,单质稳定,但其原子较活泼,则C是氮元素。通常情况下,D没有正化合价,A、B、C、E都能与D化合,所以D是氧元素。E在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族,则E是氢元素。
(1)氢氧化铝既能和酸反应生成盐和水,也能和碱反应生成盐和水,所以是两性氢氧化物,即最高价氧化物对应的水化物呈两性的物质是Al(OH)3,用离子反应方程式表示其两性的原因Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH—=AlO2—+2H2O。
(2)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则B与C简单离子的半径大小为Mg2+﹤N3—。
(3)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,即分别是水和双氧水。在一定条件下X与B反应的方程式为Mg+2H2O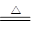 Mg(OH)2+H2↑。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,则M是氨气,N是N2H4。M的电子式
Mg(OH)2+H2↑。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,则M是氨气,N是N2H4。M的电子式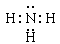 ,N的结构式
,N的结构式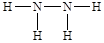 。
。
考点:考查元素周期表的结构以及元素周期律的应用和判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年昆明三中、滇池中学(本部)高一下期中考试化学卷(带解析) 题型:填空题
部分中学化学常见元素原子结构及性质如下表所示:
| 序 号 | 元素 | 结构及性质 |
| ① | A | 在地壳中的含量居于第三位,单质由电解法制取,其化学性质活泼,但在空气中能稳定存在;其离子半径在同周期中金属离子中最小。 |
| ② | B | B原子最外层电子数是内层电子数的1/5 |
| ③ | C | C单质分子中含化学键数最多,单质稳定,但其原子较活泼 |
| ④ | D | 通常情况下,D没有正化合价,A、B、C、E都能与D化合 |
| ⑤ | E | E在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题4物质结构 元素周期律练习卷(解析版) 题型:填空题
部分中学化学常见元素原子结构及性质如表所示:
序号元素结构及性质
①AA单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5
②BB原子最外层电子数是内层电子总数的
③CC是常见化肥的主要元素,单质常温下呈气态
④DD单质被誉为“信息革命的催化剂”,是常用的半导体材料
⑤E通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
⑥FF在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
部分中学化学常见元素原子结构及性质如表所示
|
序 号 |
元素 |
结构及性质 |
|
① |
A |
A在第三周期中简单离子半径最小 |
|
② |
B |
B原子最外层电子数是内层电子数的1/5 |
|
③ |
C |
C是常用化肥的主要元素,单质常温下呈气态 |
|
④ |
D |
通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
|
⑤ |
E |
E在周期表中可以排在IA族,也可以排在ⅦA族 |
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com