
| A. | CH3CH═CH(OH2)2CH3 | B. | CH2═CH(CH2)2CH3 | ||
| C. | CH3CH═CH-CH═CHCH3 | D. | CH3CH2═CHCH2CH3 |
分析 根据RCH=CHR'可以氧化成RCHO和R'CHO,则烯烃被氧化后生成甲醛,分子结构中应含有“CH2=”基团,通式为CH2=R(R为烃基).
解答 解:A、CH3CH=CH(CH2)2CH3氧化后生成CH3CHO和CH3(CH2)2CHO,故A错误;
B、CH2=CH(CH2)3CH3氧化后生成HCHO和CH3(CH2)2CHO,故B正确;
C、CH3CH=CHCH=CHCH3氧化后生成CH3CHO和OHCCHO,故C错误;
D、CH3CH2CH=CHCH2CH3氧化后生成CH3CH2CHO,故D错误;
故选B.
点评 本题考查有机物的氧化反应,做题时注意抓住题中关键信息,即要生成甲醛,有机结构中必含有“CH2=”基团,此为本题的关键点.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的原子最外层有4个电子 | |
| B. | 它具有+2、+4价 | |
| C. | 金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质 | |
| D. | 它的金属性比铅强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
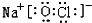 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的外围电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是④ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素X的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com