
【题目】下列实验对应的结论正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
A. A B. B C. C D. D
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】2018年12月7日12时12分,我国成功的用长征二号丁运载火箭将沙特等国的12颗卫星一次性送入预定轨道,标志着我国一箭多星发射技术已经达到国际领先水平。火箭推进器常用强还原剂液态肼(N2H4)和强氧化剂液态双氧水来产生推力。
(1)已知肼分子中每个原子的最外层电子都达到了稳定结构,请写出肼的结构式:________。
(2)肼-空气燃料电池是一种环保的碱性燃料电池,电解质溶液是20%~30%的KOH溶液.
肼-空气燃料电池放电时负极的电极反应式是________________________。
(3)由18O、16O、H、D原子组成的H2O2分子共有10种,这10种分子中共有_______种相对分子质量。
(4)一种用H2O2处理剧毒物质NaCN的化学方程式是NaCN+H2O2→N2↑+X+H2O,则X的化学式是____________。
(5)强氧化剂液态H2O2也可以用NO2、或F2代替,试写出N2H4与F2的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是
A. 天然气是二级能源 B. 石油是二级能源
C. 电能是一级能源 D. 水力是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了_________________。
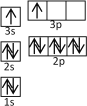
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为______。
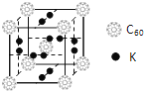
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2+Cl2=2HCl为例分析反应过程中能量的变化:
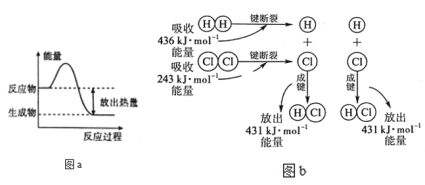
(1)由图a可知:反应物所具有的总能量__生成物所具有的总能量(填“大于、小于或等于”),所以该反应要___(吸收或放出)能量,能量变化值的大小△E=____(用E反和E生表示)。
(2)由图b可知:断裂反应物中的化学键吸收的总能量为E吸=___kJ;形成生成物中的化学键放出的总能量为E放=_____kJ。所以该反应要____(填“吸收” 或“放出”)____kJ(填数值)的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
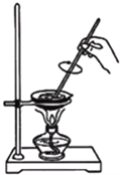
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为________。
(2)B中发生反应的化学方程式为_______________。
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为____________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数(用a、c表示)将________(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是
A. 2CH4(g)4O2(g)=2CO2(g)+4H2O(l)△H═+89 kJ/mol
B. CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═﹣890 kJ/mol
D. ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l)△H═﹣890 kJ/mol
CO2(g)+H2O(l)△H═﹣890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com