
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_______;正极的电极反应式为____________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,则负极的电极反应式为_____________________;
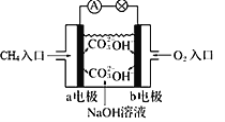
②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O,铅蓄电池负极的电极反应式为_____;充电时,铅蓄电池的PbO2极应与外加直流电源的____极相连。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为____mol。
【答案】铜或Cu O2+4e-+4H+=2H2O CH4+10OH--8e-=CO32-+7H2O Pb +SO42--2e-=PbSO4 正 阳 4
【解析】
根据原电池、燃料电池、铅蓄电池原理判断正负极及书写相关电极反应式;根据电解精炼铜原理分析阴阳极、结合电子守恒进行相关计算。
(1)原电池中负极失去电子,发生氧化反应,化合价升高,根据总反应知,Cu化合价升高,则该电池的负极材料为Cu;正极得电子,发生还原反应,正极的电极反应式为:O2+4e-+4H+=2H2O;
(2)①如图所示该电池为碱性燃料电池,甲烷作负极,失电子后结合氢氧根生成碳酸根,则负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
②根据总反应分析知,放电时,铅蓄电池负极失去电子,化合价升高,电极反应式为:Pb +SO42--2e-=PbSO4;充电时,铅蓄电池的PbO2极要转化为Pb,发生还原反应,所以应与外加直流电源的正极相连;
(3)精炼时,粗铜要被溶解发生氧化反应,所以做阳极;当阴极增重128 g时,n(Cu)=![]() =2mol,阴极电极反应为Cu2++2e-=Cu,由总反应PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O~2e-得:n(硫酸)=n(e-)=2mol×2=4mol。
=2mol,阴极电极反应为Cu2++2e-=Cu,由总反应PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O~2e-得:n(硫酸)=n(e-)=2mol×2=4mol。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:

①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是( )
A. ①③B. ①②④C. ②③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碳燃烧的热化学方程式为C(s)+1/2O2(g)=CO(g) ΔH=+110.5kJ·mol-1
B. 镀锌铁皮发生电化学腐蚀时,负极反应式为:Zn-2e–= Zn2+
C. NaHS水解的离子方程式是:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
D. 溶液中碳酸的电离方程式为:H2CO3![]() 2H++ CO32–
2H++ CO32–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是( )
A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B. 用于人民币票面文字等处的油墨中所含有的![]() 是一种磁性物质
是一种磁性物质
C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉
D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,见光易分解,在潮湿空气中易被氧化,难溶于水、稀盐酸和乙醇。实验室用如图所示装置制取CuCl。以下说法正确的是( )

A.装置A中发生的反应是氧化还原反应
B.装置B中的搅拌子是由铁直接铸造
C.装置B中反生反应的离子方程式是SO2+2Cu2++2Cl-+2H2O=2CuCl↓+4H++SO42-
D.装置C中用干燥管替代导管的主要目的是使剩余的SO2能被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,常温下B、D为气态化合物,C为液态化合物,图中有部分生成物未标出。已知﹕2Mg+CO2![]() 2MgO+C。
2MgO+C。
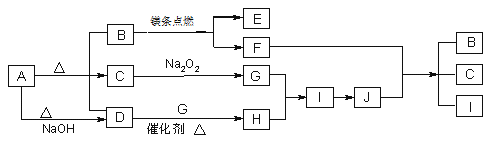
请回答下列问题:
(1)写出A的化学式:___。
(2)写出下列反应的化学方程式:
D+G→H___。
F+J→B+C+I___。
(3)写出A+NaOH→D的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。

(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)=________;CO2的转化率w(CO2)=________。
②该反应的平衡常数K=_____________。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是________________(填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:______________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com