
分析 ①质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
②质子数相同,而中子数不同的原子,互称为同位素;
③原子符号左上角的数字为质量数;中子数=质量数-质子数.
解答 解:①11H、21H、31H、都属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有6种核素,5种元素,
故答案为:6;5;
②11H、21H、31H、都属于氢元素,质子数相同,而中子数不同互为同位素,
故答案为:11H、21H、31H;
③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,
故答案为:14C;14N; 14C、16O.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念、核外电子数的计算、试题培养了学生的分析能力及概念实质的理解能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
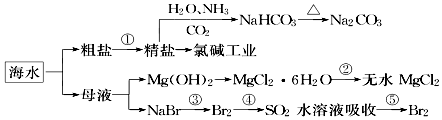 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 mL 4℃的水中所含分子数约为1.5 NA个 | |
| B. | 电解精炼铜时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 | |
| C. | 标准状况下,22.4L乙烯中共价键数目为8 NA | |
| D. | pH=1的硫酸溶液所含的H+数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
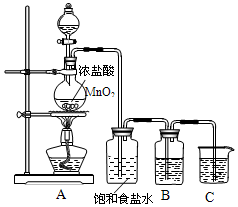 实验室制取氯气的装置如图:
实验室制取氯气的装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com