
| A. | R 原子的最外层上有 4 个电子 | B. | RO3 n- 中的 R 只能被还原 | ||
| C. | R 的单质既有氧化性又具有还原性 | D. | HnRO3一定是强酸 |
分析 ROn-3+2R2-+6H+=3R+3H2O中,由电荷守恒可知,n=2,R的最低负价为-2价,则最高正价为+6价,最外层电子数为6,该元素可能为S,再结合离子中S元素的化合价来分析解答.
解答 解:A.由R2-可知,R的最低负价为-2价,则最高正价为+6价,最外层电子数为6,故A错误;
B.RO3n-+2R2-+6H+=3R+3H2O中,由电荷守恒可知,n=2,则最高正价为+6价,所以RO3n-中的R的化合价为+4价,既能被氧化又能被还原,故B错误;
C.R的单质中元素的化合价为0,既能升高又能降低,所以R的单质既有氧化性又有还原性,故C正确;
D.若R为S,则HnRO3是弱酸,故D错误;
故选C.
点评 本题考查氧化还原反应,明确电荷守恒、元素的化合价及元素的性质与化合价的关系即可解答,题目难度不大,A为易错点.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的氧化性逐渐减弱,密度逐渐增大,熔沸点逐渐升高 | |
| B. | HF、HCl、HBr、HI的热稳定性逐渐减弱 | |
| C. | F-、Cl-、Br-、I-的还原性逐渐增强,颜色逐渐变深 | |
| D. | 与水反应由难到易:F2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | 饱和NaHCO3溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


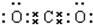


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com