
| A. | ①② | B. | ②③⑤ | C. | ②⑤ | D. | ④⑥ |
分析 ①电解质不一定是离子化合物;
②强电解质能完全电离;
③AlCl3在水溶液中能导电;氨水能导电是由于一水合氨的原因;
④强电解质不一定是离子化合物,弱电解质不一定是共价化合物;
⑤在水溶液中或熔融状态下能导电的化合物为电解质;
⑥溶液的导电性的强弱取决于离子浓度的大小.
解答 解:①电解质不一定是离子化合物,如HCl是电解质,但其由原子构成,故①错误;
②强电解质能完全电离,故强电解质溶液中无溶质分子,故②正确;
③AlCl3在水溶液中能导电,故氯化铝为电解质;氨气溶于水能导电,是由于生成的一水合氨电离出了自由移动的离子的原因,与氨气本身无关,故氨气为非电解质,故③正确;
④强电解质不一定是离子化合物,如HCl是共价化合物但为强电解质;弱电解质不一定是共价化合物,故Al(OH)3为离子化合物但为弱电解质,故④错误;
⑤在水溶液中或熔融状态下能导电的化合物为电解质,故电解质不一定能导电;能导电的不一定为共价化合物,故单质铁,故⑤正确;
⑥溶液的导电性的强弱取决于离子浓度的大小,与电解质的强弱无关,故⑥错误.
故选B.
点评 本题考查了电解质非电解质的判断和影响溶液导电性的愿意,难度不大,应注意的是电解质不一定能导电,能导电的物质也不一定是电解质.


科目:高中化学 来源: 题型:选择题
| A. | 氯水与足量的 FeBr2溶液反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | NaHCO3溶液与 NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2;溶液反应:CO32-+Ca2+=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
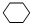 ,名称是环己烷,该烃的二氯代物有4种.
,名称是环己烷,该烃的二氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②④③① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| D. | 水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A一定不是气态物质 | B. | A一定是气态物质 | ||
| C. | B一定不是气态物质 | D. | B一定是气态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3?Fe3++3OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O2- | D. | H2S?2H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2LCO和2L CO2 | |
| B. | 9克H2O和标准状况下11.2L CO2 | |
| C. | 标准状况下1mol O2和22.4L H2O | |
| D. | 0.2mol H2和标准状况下4.48L HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com